
题目列表(包括答案和解析)
5.下列元素中,最高正化合价数值最大的是
A.C B.F C.S D.Ne
4.下列物质的电子式书写正确的是

3.提出元素周期律并根据元素周期律编制第一个元素周期表的科学家是
A、道尔顿 B、普利斯特里 C、门捷列夫 D、阿伏加德罗
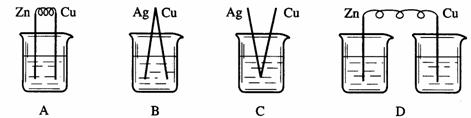
2.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是
1.1999年,世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说,原子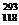 X的中子数为
X的中子数为
A.0 B.57 C.118 D.175
0.(1)锌,9.6g.(2)3mol.(3)0.75mol/L.
(1)由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌(1分)
锌片:Zn-2e-=Zn2+ 铜片:2H++2e-=H2↑ (1分)
总反应:Zn+2H+=H2↑+Zn2+
n(H2)=3.36/22.4=0.15mol --------------- (1分)
n(Zn)=n(H2)=0.15mol
m(Zn)=0.15×65=9.75g --------------------- (1分)
(2)1molZn失去2e,所以通过导线的电子物质的量为2×0.15=0.3mol(1分)
(3) H守恒,H+全部由H2SO4提供,
所以n(H2)=n(H2SO4)=0.15mol-----------------------------(2分) c(H2SO4)=0.15/0.2=0.75mol/L-------------------------(1分)
21.(10分)
(1)2Al+6HCl=2AlCl3+3H2↑
(2分,化学式有错者得0分,未配平者扣1分。不标气体符号的扣1分)
(5)②5mL; 35mL;10mL。(各1分,共3分;顺序错者不给分)
速率大小比较:EF>FG>OE。(1分)
原因:该反应是放热反应,随着温度的升高,反应速率增大,一段时间后,随着反应物的浓度的减小,反应速率减小。(2分)
③A、B (2分,有错选不给分,漏选一个扣1分)
20. (9分)(1)A: 不能(1分) B:能(1分)
原因:A的反应属于非氧化还原反应,没有电子转移。
(1分,意思对即可给分)
(2)①负极材料:铜片(1分) 正极材料是:石墨(1分,答案合理即可)
电解质溶液:FeCl3溶液 (1分,答案合理即可)
②正极的电极反应式: Fe3+ + e- == Fe2+ (2分,有一处错就不给分)
还原反应(1分)
(2)3Cu + 8H+ +2NO3-= === 3Cu2++ 2NO↑ + 4H2O
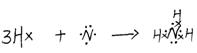 (2分,化学式有错者得0分,未配平者扣1分。不标气体符号的扣1分)
(2分,化学式有错者得0分,未配平者扣1分。不标气体符号的扣1分)
(3)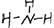 (1分)极性键(1分),有错别字者不给分) (1分)
(1分)极性键(1分),有错别字者不给分) (1分)
(4)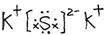 (1分)
(1分)
19.(方程式2分,其余每空1分,共8分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com