
题目列表(包括答案和解析)
2.本章共有三节内容,即钠、钠的化合物和碱金属元素.教材开始就指出碱金属元素的原子结构的特征,接着便具体地研究金属钠的物理性质和化学性质;在认识钠的性质的基础上,进一步阐明它在自然界里的存在、制法、用途以及钠的重要化合物;最后归纳出碱金属元素的通性及其递变规律.这样的编排,充分体现了由个别到一般的认识规律,加深了学生对碱金属元素原子结构的认识和丰富了结构与性质的相互关系的知识,帮助学生进一步建立物质的结构决定物质性质的观点.
1.碱金属是典型的金属元素,具有很强的代表性.通过本章内容的学习,初步学会分析物质结构决定物质性质的方法,提高归纳物质结构、性质变化规律的能力.为学习第四章和第五章奠定一定的基础.本章很多知识点是历年高考的热点.高考试题中碱金属内容的分值占总分值的4%左右,是高考重点考查的元素化合物知识,特别是钠、氢氧化钠、过氧化钠、碳酸钠、碳酸氢钠的有关问题,高考几乎年年考查。
将70gNa2O2和Na2O的混合物跟98g水充分反应后,所得溶液中溶质的质量分数为50%.试分别写出Na2O2和Na2O跟水反应的化学方程式,并计算原混合物中Na2O2和Na2O的质量各是多少克.
答案: 2Na2O2+2H2O=4NaOH+O2↑;Na2O+H2O=2NaOH;
m(Na2O2)=39 g;m(Na2O)=31 g
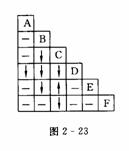
现有A-F六种五色未知溶液,它们是Na2CO3、BaCl2、KI、Ca(NO3)2、AgNO3和稀H2SO4,将瓶内溶液各取少许两两混合,实验结果如图2-23所示,图中“↑”“↓”-”符号分别表示生成沉淀、放出气体和无明显变化,若混合后有微溶物,也用“-”表示.请写出这六种溶液的化学式:
A_____;B_____;C_____;D_____;
E_____;F_____.
答案:KI;BaCl2;Na2CO3;AgNO3;稀H2SO4;Ca(NO3)2
称取一定量的纯碱,溶于水后,与酸反应放出CO2.用“增多”或“减少”填空:
(1)若纯碱中含NaHCO3,则所需盐酸用量____,产生气体______;
(2)若纯碱中含Li2CO3,则所需盐酸用量______,产生气体_______;
(3)若纯碱中含K2CO3,则所需盐酸用量______,产生气体______;
(4)若纯碱中含Ca(HCO3)2,则所需盐酸用量______,产生气体______.
答案:(1)减少;增多 (2)增多;增多 (3)减少;减少 (4)减少;增多
4.在干燥器(内放无水氯化钙固体颗粒)中放入一个盛有碳酸钠晶体的小烧杯,将干燥器的盖子盖紧,过相当长的一段时间后发现下列两种现象:
(1)碳酸钠晶体变成_______,此现象称为_______;
(2)无水氯化钙________,此现象称为_______.
答案:(1)白色粉末;风化 (2)变成晶体且表面有溶液生成;潮解
3.在碱金属的化合物中,碱性氧化物中氧的化合价是______价,_____价的氧既有氧化性又有还原性.
答案:-2;-1
 1.钠在空气中缓慢氧化,生成______色的_______,钠在空气中燃烧生成色的______.金属钠、氧化钠、过氧化钠的稳定性由强到弱的顺序是________.
1.钠在空气中缓慢氧化,生成______色的_______,钠在空气中燃烧生成色的______.金属钠、氧化钠、过氧化钠的稳定性由强到弱的顺序是________.
答案:白;Na2O;淡黄;Na2O2;Na2O2>Na2O>Na
2.鉴别HCl和NaOH,可采用________的方法;鉴别NaOH和KOH,可采用的方法;鉴别Na2CO3溶液和NaHCO3溶液可采用_______的方法.
答案:加酸碱指示剂(或用pH试纸);焰色反应;滴加BaCl2溶液看是否有沉淀生成
19.下列叙述中,不正确的是 ( )
A.钠在反应TiCl4+4Na=Ti+4NaCl中作还原剂
B.NaOH应密封保存,以防分解变质
C.金属钾应保存在煤油中
D.当足量CO2通入到饱和Na2CO3溶液中时,有NaHCO3结晶析出
答案:B[提示:NaOH应密封保存,但不是因为其分解变质,而是防止其先吸水再与CO2作用,最后转化为Na2CO3粉末]
18.下列离子方程式中,书写正确的是 ( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
C.碳酸氢钠与盐酸反应:CO2-3+2H+=CO2↑+H2O
D.碳酸氢钠溶液与足量石灰水反应:
2HCO-3+Ca2++2OH-=CaCO3↓+CO2↑+2H2O
答案:B[提示:A中质量不守恒;C中HCO-3不能拆;D中由于石灰水足量,故反应的化学方程式应为:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,其离子方程式应为:HCO-3+Ca2++OH2=CaCO3↓+H2O]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com