
题目列表(包括答案和解析)
9、有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C
C.D>B>A>C D.B>A>D>C
8、下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
7、氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的NaOH转变为Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂;盐酸浓度的测定结果会
A.偏低1% B.偏高1% C.无影响 D.偏高0.1%
6、强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH-(aq)=H2O(1);⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是
A.⊿H1>⊿H2>⊿H3 B.⊿H1<⊿H3<⊿H2
C.⊿Hl<⊿H2<⊿H3 D.⊿H1>⊿H3>⊿H2
5、可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变 B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等 D.反应容器内的气体总物质的量不随时间变化
4、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A. 加热 B. 不用稀硫酸,改用98%浓硫酸
C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉
3、有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1
C.V3>V2=V1 D.V1=V2>V3
1、反应A(g)+3B(g)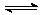 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.V(D)=0.4 mol / (L·s) B.V (C)=0.5 mol / (L·s)
C.V(B)=0.6 mol / (L·s) D.V (A)=0.15 mol / (L·s)
2、对可逆反应4NH3(g) + 5O2(g) 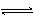 4NO(g)
+ 6H2O(g),下列叙述正确的是
4NO(g)
+ 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4 V正(O2) = 5 V逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2 V正(NH3) = 3 V正(H2O)
28. (8分)将一种特种铸铁合金(主要成分为FenC)和铝的混合物用250 ml某浓度的稀酸充分溶解后(已知FenC+nH2SO4=nFeSO4+ H2↑+C),得到FeSO4和Al2(SO4)3的混合溶液和黑色沉淀。沉淀经过滤、洗涤、干燥后称量为0.24g。洗涤液和溶液合并后,通入适量氯气氧化(假设氯气恰好完全反应)。将所得溶液取出 ,逐滴加入4.00
mol•L-1的NaOH溶液,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。请回答下列问题:
(8分)将一种特种铸铁合金(主要成分为FenC)和铝的混合物用250 ml某浓度的稀酸充分溶解后(已知FenC+nH2SO4=nFeSO4+ H2↑+C),得到FeSO4和Al2(SO4)3的混合溶液和黑色沉淀。沉淀经过滤、洗涤、干燥后称量为0.24g。洗涤液和溶液合并后,通入适量氯气氧化(假设氯气恰好完全反应)。将所得溶液取出 ,逐滴加入4.00
mol•L-1的NaOH溶液,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。请回答下列问题:
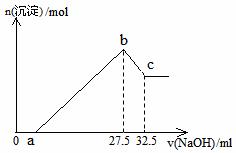 (1)写出b点到c点反应的离子方程式
(1)写出b点到c点反应的离子方程式
▲
(2)若a为5,则n为 ▲
(3)若a为5,则稀硫酸的物质的量浓度为
▲ mol•L-1
27.(7分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适的反应条件下,它们可以按下框图进行反应;又知单质A是当今世界产量最大的金属,E溶液是无色的酸性溶液。
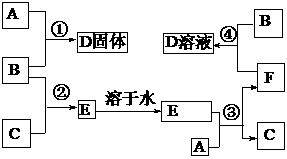
请回答:
(1)A是 ▲ ,B是 ▲ ,C是 ▲ (请填写化学式);
(2)反应③的化学方程式 ▲ ;
(3)反应④的离子方程式 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com