
题目列表(包括答案和解析)
10、常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中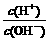 =1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
( )
=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
( )
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)>c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(OH-)>c(H+) D.c(B+)>c(A-)>c(H+)>c(OH-)
9、能正确表示下列反应的离子方程式是 ( )
A.苯酚钠溶液中通入少量CO2: -O-+CO2+H2O→
-O-+CO2+H2O→ -OH+HCO3-
-OH+HCO3-
B.硫化钠的水解:S2-+2H2O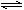 H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO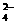
BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-
CaCO3↓+H2O
8、下列说法或表示方法中,正确的是 ( )
A.由热化学方程式:1/2C2H5OH(l)+3/2O2(g) CO2(g)+3/2H2O(l)
△H=-683.4kJ/mol知乙醇的燃烧热为683.4kJ/mol
B.由C(金刚石)→ C(石墨):△H= -119 kJ/mol可知,金刚石比石墨稳定
C.H+(aq) + OH一(aq) = H2O(1);△H=-57.3KJ/mol。
若将含0.5mol H2SO4的浓硫酸与含1molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101kPa 25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,
则氢气燃烧的热化学方程式表示为:2H2(g) + O2(g) == 2H2O(1);△H = -285.8 kJ/mol
7、下列说法中正确的是 ( )
A.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率是
前者大于后者
B.100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等
C.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量前者小于后者.
D.100 mL 0.1 mol·L-1的硫酸和盐酸溶液,与足量锌反应后,两者放出氢气的速率相等但质量不相等
6、由2一氯丙烷制取少量1,2一丙二醇时,需要经过下列哪几步反应 ( )
A.消去→加成→水解 B.加成→消去→取代
C.消去→加成→消去 D.取代→消去→加成
5、据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物。

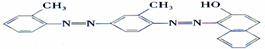
红心鸭蛋 苏丹红Ⅳ号
下列关于“苏丹红Ⅳ号”说法正确的是 ( )
A.属于芳香烃 B.能与NaOH溶液反应
C.不能使酸性KMnO4溶液褪色 D.不能发生加成反应
4、2005年10月12日我国成功发射了“神州六号”。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g) 2NO2(g);△H =+67.7kJ/mol
N2H4(g)+O2(g) N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是 ( )
 A.2N2H4(g)+2NO2(g)
A.2N2H4(g)+2NO2(g) 3N2(g)+4H2O(l);△H=-1135.7kJ/mol
B.2N2H4(g)+2NO2(g) 3N2(g)+4H2O(g);△H=-1000.3kJ/mol
C.N2H4(g)+NO2(g) 3/2N2(g)+2H2O(l);△H=-1135.7kJ/mol
D.2N2H4(g)+2NO2(g) 3N2(g)+4H2O(g);△H=-1135.7kJ/mol
3、设C+CO2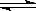 2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2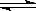 2NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为
( )
2NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为
( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
2、有关化学用语正确的是 ( )
A.乙炔的最简式C2H2 B .乙醛的结构简式 CH3COH
C .水的电子式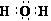 D. 硬脂酸甘油脂
D. 硬脂酸甘油脂
1、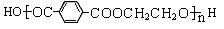 2008年北京奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维(结构简式如右图)。下列说法不正确的是
( )
2008年北京奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维(结构简式如右图)。下列说法不正确的是
( )




A.羊毛与聚酯纤维的化学成分不相同 B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙二醇 D.由单体合成聚酯纤维的反应属于加聚反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com