
题目列表(包括答案和解析)
27.(8分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B、C和E均为2.0mol,设D为xmol、F为ymol。当x、y在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。
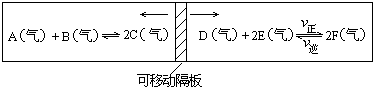 (1)若x=1、y=3,反应
(1)若x=1、y=3,反应
(填A.正向进行
B.逆向进行
C.已达平衡状态)。
其理由是 。
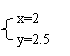
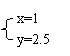
(2)若 与 , 则在这两种情况下,当反应达平衡时,A的物质的量是否相等? ,(填A相等、B不相等或C不能确定).其理由是: 。
高二化学科第二学期期中考试试卷
26.(16分)一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_______ __;x=_________。
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”)。
③平衡混合物中,C的体积分数(物质的量分数)为22%,则A的转化率是_________。
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系:n(A)、n(C) 关系为______ _ ,n(A)、n(B) 关系为_ 。
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体。
25.(6分)某化学研究性学习小组在研究氨氧化制硝酸的过程中,查到如下资料:
①氨气催化氧化为NO的温度在600℃左右。
②NO在常压下,温度低于150℃时,几乎100%氧化成NO2。高于800℃时,则大部分分解为N2。
③NO2在低温时,容易聚合成N2O4,2NO2 N2O4,此反应且能很快建立平衡,在21.3℃时,混合气体中N2O4占84.1%,在150℃左右,气体完全由NO2组成。高于500℃时,则分解为NO。
N2O4,此反应且能很快建立平衡,在21.3℃时,混合气体中N2O4占84.1%,在150℃左右,气体完全由NO2组成。高于500℃时,则分解为NO。
④NO与NO2可发生下列可逆反应:NO+NO2 N2O3,N2O3很不稳定,在液体和蒸气中大部分离解为NO和NO2,所以在NO氧化为NO2过程中,含N2O3只有很少一部分。
N2O3,N2O3很不稳定,在液体和蒸气中大部分离解为NO和NO2,所以在NO氧化为NO2过程中,含N2O3只有很少一部分。
⑤亚硝酸(HNO2)只有在温度低于3℃和浓度很小时才稳定。
试问:(1)在NO氧化为NO2的过程中,还可能有气体 (填化学式)产生。
(2)在工业制硝酸的第一步反应中,氨的催化氧化需要过量的氧气,但产物主要是NO,而不是NO2,原因是 。
(3)在处理尾气时,选用氢氧化钠溶液吸收,而不用水吸收,理由是 。
24.(8分)甲烷蒸气转化反应为:CH4(g)+H2O(g) CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
已知温度、压强和水碳比[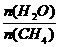 ]对甲烷蒸气转化反应的影响如下图:
]对甲烷蒸气转化反应的影响如下图:
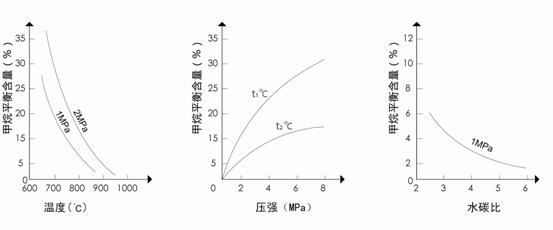
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
⑴该反应平衡常数K表达式为________________________。
⑵升高温度,平衡常数K__________(选填“增大”、“减小”或“不变”,下同),
降低反应的水碳比,平衡常数K__________。
⑶图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
23.(8分)将2 mol SO3气体和2 mol NO置于1 L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g) 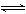 2SO2(g)+O2(g)、2NO(g)+O2(g)
2SO2(g)+O2(g)、2NO(g)+O2(g) 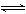 2NO2(g)。
2NO2(g)。
⑴当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.05 mol、n(NO2)=1.8 mol,则此时SO3气体的物质的量为 mol。
⑵当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
⑶在其它条件不变的情况下,若改为起始时在2L容器中充入4molNO2和4 molSO2,则上述两反应达到平衡时,c (SO2)平= mol/L。
22.(5分)对于A+2B(g) nC(g) ,在一定条件下达到平衡后,改变下列条件,请回答:
nC(g) ,在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为________态。
(2)增压,平衡不移动,当n=2时,A为___ _态;当n=3时,A为______态。
(3)若A为固态,增大压强,C的组分含量减少,则n_________。
(4)升温,平衡向右移动,则该反应的逆反应为_______热反应。
21.(10分)用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置
中进行中和反应。测定强酸与强碱反应的反应热。
|
|
起始温度t1/℃ |
终止温度 t2/℃ |
温度差 (t2-t1) /℃ |
||
|
HCl |
NaOH |
平均值 |
|||
|
1 |
25.5 |
25.0 |
25.25 |
28.5 |
3.25 |
|
2 |
24.5 |
24.5 |
24.50 |
27.5 |
3.00 |
|
3 |
25.0 |
24.5 |
24.75 |
26.5 |
1.75 |
|
|
|
|
|
|
|
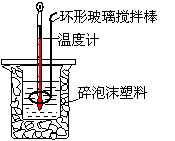
(1)在该实验中,量取50 mL 盐酸或NaOH 溶液,需要用到的玻璃仪器是 。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________ __ _。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是 。
(4)若大烧杯上不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”或“无影响”)。
(5) 如果用50 mL 0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其△H会偏大,其原因 。
20.(2分)将相等物质的量的CO和H2O(g)混合,在一定条件下反应:
CO(g)+ H2O(g) CO2(g)+
H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密
CO2(g)+
H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密
度是相同条件下氢气的倍数是 。
19.已知胆矾溶于水使溶液温度降低,室温下将1mol无水硫酸铜制成溶液释放出热量为Q1kJ,又知胆矾分解的化学方程式为:CuSO4·5H2O CuSO4(固)+5H2O ΔH= +Q2kJ,则Q1 、Q2的关系为( )
CuSO4(固)+5H2O ΔH= +Q2kJ,则Q1 、Q2的关系为( )
A. Q1 <Q2 B. Q1 >Q2 C. Q1 =Q2 D.无法确定
第Ⅱ卷 非选择题(共55分)
18.已知可逆反应aA+bB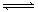 cC中,物质的含量
cC中,物质的含量
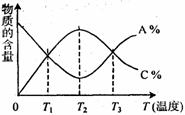 A%和C%随温度的变化曲线如图所示,下列说法正
A%和C%随温度的变化曲线如图所示,下列说法正
确的是( )
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是吸热反应
D.升高温度,平衡会向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com