
题目列表(包括答案和解析)
5、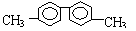
 .已知C-C单键可以绕键轴旋转,其结构简式可表示为
的烃,下列说法中正确的是( )
.已知C-C单键可以绕键轴旋转,其结构简式可表示为
的烃,下列说法中正确的是( )
A、.分子中至少有4 个碳原子处于同一直线上
B、该烃的一氯代物最多有四种
C、分子中至少有10个碳原子处于同一平面上
D、.该烃是苯的同系物
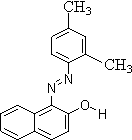
4、苏丹红是很多国家禁止用于食品生产的合成色素.结构简式如右图.关于苏丹红说法错误的是: ( )
A 分子中含一个苯环和一个萘环 B 属于芳香烃
C 能被酸性高锰酸钾溶液氧化 D 能溶于苯
3、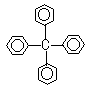 甲烷分子中的4个氢原子都可以被取代.若甲烷分子中的4个氢原子被苯基取代,则可得到的分子如图所示,对该分子的描述中,不正确的是:
( )
甲烷分子中的4个氢原子都可以被取代.若甲烷分子中的4个氢原子被苯基取代,则可得到的分子如图所示,对该分子的描述中,不正确的是:
( )
A.化学式为C25H20 B.此物质属芳香烃类物质
C.所有碳原子都在同一平面上 D.最多有13个碳原子在同一平面上
2、已知下列有机物:①硝基苯;②环己烷;③甲苯;④苯磺酸;⑤溴苯;⑥邻二甲苯。其中不能由苯通过一步反应直接制取的是: ( )
A、 ②④ B、 ①③⑤ C、 ①②⑥ D、 ③⑥
1、将下列各种液体分别与溴水混合并振荡,不能发生反应,静置后溶液分层,且上层液体几乎无色的是: ( )
A、CCl4 B、己烯 C、苯 D、酒精
26、(16分)随着纳米技术的飞速发展,四氧化三铁纳米颗粒在磁性记录、磁流体、吸波、催化、医药等领域有着广泛的应用。“共沉淀法”是制备四氧化三铁纳米颗粒的常见方法,具体步骤为:将一定量的FeCl2·4H2O和FeCl3·6H2O制成混合溶液加入到烧瓶中,在N2气氛下,滴加氨水、搅拌、水浴恒温至混合液由橙红色逐渐变成黑色,继续搅拌15 min,磁铁分离磁性颗粒,用蒸馏水洗去表面残留的电解质,60℃真空干燥并研磨,可得直径约10 nm Fe3O4磁性颗粒。
(1)“共沉淀法”中N2的作用是__________ ___,制备的总离子反应方程式为______________ ___ _。
(2)在医药领域,四氧化三铁纳米颗粒经表面活性剂修饰后,被成功制成磁性液体,又称磁流体(见图a)。磁流体属于_________ _分散系,负载药物后通过静脉注射或动脉注射进入人体,利用四氧化三铁具有_____________功能,在外界磁场的作用下,富集于肿瘤部位,当外磁场交变时,可控释药。
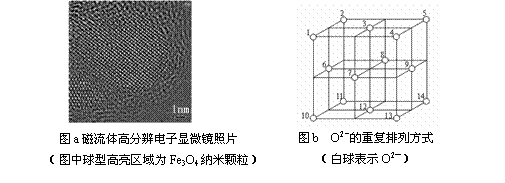
(3)科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图b所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______ _,其中有_____ _%正四面体空隙填有Fe3+,有_______ _%正八面体空隙没有被填充。
25、(12分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 (1)比较下列两组物质的熔点高低(填“>”或“<”
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
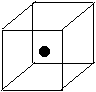
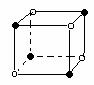
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g) 该反应的反应热△H = kJ/mol.
24、(12分)科学家发现C60分子由60个碳原子构成,它的形状像足球(图C),含有C=C键,因此又叫足球烯。1991年科学家又发现一种碳的单质--碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图D),图A、图B分别是金刚石和石墨的结构示意图。图中小黑点或小黑圈均代表碳原子。
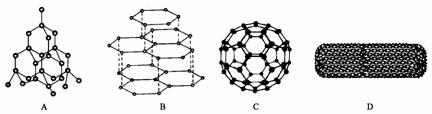
(1)金刚石、石墨、足球烯和碳纳米管四种物质互称为同素异形体,它们在物理性质上存在较大的差异,其原因是___________ _____ ;
(2)同条件下,足球烯、石墨分别和气体单质F2反应时,化学性质活泼性的比较为足球烯比石墨 (填“活泼”、“一样活泼”、“更不活泼”)理由是:
______ ;
(2)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决H2的贮存问题,上述四种碳单质中有可能成为贮氢材料的是:_______ _______。
(3).下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是
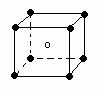

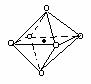
⑴ ⑵ ⑶ ⑷
A、⑴ B、⑵ C、⑶ D、(4)
23、(16分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
a |
|
|
|||||||||||||||
|
b |
|
|
|
c |
d |
e |
f |
|
|||||||||
|
g |
h |
i |
j |
|
k |
l |
m |
||||||||||
|
n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
 试回答下列问题:
试回答下列问题:
(1)请写出元素O的基态原子电子排布式
。
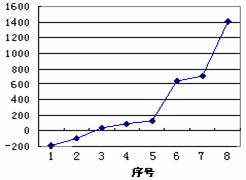
(2)第三周期8种元素按单质熔点高低
的顺序如右图,其中序号“8”代表
(填元素符号);其中电负性最大的是
(填右图中的序号)。
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相
比熔点更高的是 (填化学式),试从结构角度加以解释:
。
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
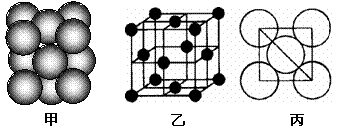
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为___ ___ _ ,一个晶胞中i原子的数目为_ _;
②该晶体的密度为______ _ (用字母表示)。
22、(8分)美国《科学》杂志评选的2001年十大科技进展之一是当年科学家发现了一种在接近40K的温度下成为超导材料的硼镁化合物。这种硼镁超导物质的晶体结构单元如右图所示:
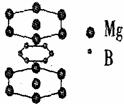 (1)试写出这种超导材料的化学式
;
(1)试写出这种超导材料的化学式
;
(2)该晶体的类型为__________ _晶体。
(3)分别叙述该晶体中含有的化学键类型。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com