
题目列表(包括答案和解析)
3. 下列不能用于金属防腐处理的是( )
A. 涂油漆 B. 改变金属内部结构
C. 镀上一层耐腐蚀的金属 D. 在海轮的船体上镶铜块
2. 以下现象与电化学腐蚀无关的是( )
A. 黄铜(铜锌合金)制作的锣不易产生铜绿
B. 生铁比纯铁容易生锈
C. 铁质配件附有铜质配件,在接触处易生铁锈
D. 银质物品久置表面变暗
1. 下列叙述不正确的是( )
A. 金属的电化腐蚀比化学腐蚀普遍 B. 钢铁在干燥空气里不易腐蚀
C. 用铝质铆钉接铁板,铁板易被腐蚀 D. 原电池电路中电子由负极流入正极
15. 已知常温下FeS的Ksp=6.25×10-18。
(1)常温下FeS的溶解度为多少g?(设饱和溶液的密度为1g•cm-3)
(2)在常温下将过量FeS投入到0.10mol•L-1的Na2S溶液中,则平衡时c(Fe2+)为多少?
14. 在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
(1)若加入AgNO3固体,c(I-) 。
(2)若加入更多的AgI固体,则c(Ag+) 。
(3)若加入固体AgBr,c(I-) 。
13. 下列对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的原因解释中正确的有( BD )
A. Mg(OH)2的Ksp大于MgCO3的Ksp,且在水中发生了沉淀转化
B. Mg(OH)2的Ksp小于MgCO3的Ksp,且在水中发生了沉淀转化
C. MgCO3电离出的CO32-发生水解,使水中c(OH-)减小,对Mg(OH)2的沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
D. MgCO3电离出的CO32-发生水解,使水中c(OH-)增大,对Mg(OH)2的沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀
12. 氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的( BD
)
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的( BD
)
A. NaOH B. NH4Cl C. MgSO4 D. NaHSO4
11. 下表是五种银盐的溶度积常数(25℃):
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法错误的是( C )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
10.(2008山东理综,15)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( C )
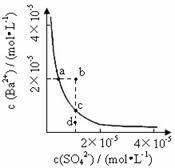 提示:BaSO4(s)
提示:BaSO4(s)  Ba2+(aq)+SO42-
(aq)的平衡常数Ksp=c(Ba2+)•c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-
(aq)的平衡常数Ksp=c(Ba2+)•c(SO42-),称为溶度积常数。
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
9.已知:Ksp(Ag2SO4)=1.4×10-5mol3•L-3,Ksp(Ag2CO3)=8.1×10-12mol3•L-3,Ksp(AgCl)=1.8×10-10mol2•L-2,Ksp(AgI)=8.3×10-17mol2•L-2在下列各饱和溶液中,c(Ag+)由大到小的顺序是( B )
A. Ag2SO4>AgCl>Ag2CO3>AgI B. Ag2SO4>Ag2CO3>AgCl>AgI
C. Ag2SO4>AgCl>AgI>Ag2CO3 D. Ag2SO4>Ag2CO3>AgI>AgCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com