
题目列表(包括答案和解析)
18.有一化学平衡:mA(g)+nB(g)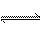 pC(g)+qD(g)。如右图,表示的是A的转化率与压强、温度的关系。分析图中曲线可以得出的结论是
pC(g)+qD(g)。如右图,表示的是A的转化率与压强、温度的关系。分析图中曲线可以得出的结论是
A.正反应吸热,m+n>p+q B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q D.正反应放热,m+n<p+q
17.某温度下,反应2NO2 (g) N2O4(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变条件的可能有
N2O4(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变条件的可能有
A.保持容器容积和温度不变,向容器内补充了NO2
B.保持温度、压强不变,向容器内补充了N2
C.保持容器压强和温度不变,向容器内补充了N2O4
 D.保持容器的容积不变,升高了温度
D.保持容器的容积不变,升高了温度
16.为更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG==lg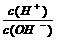 则下列叙述正确的是
则下列叙述正确的是
A.中性溶液的AG=1 B、常温下0.1 mol·L-1氢氧化钠溶液的AG=12
C.酸性溶液的AG<0 D.常温下0.1 mol·L-1盐酸溶液的AG==12
15.右下图是关于反应A2(g)+3B2(g)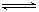 2C(g);△H <0的平衡移动图象,影响平衡移动的原因可能是
2C(g);△H <0的平衡移动图象,影响平衡移动的原因可能是
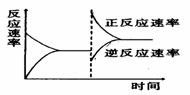 A.升高温度,同时加压
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
14.下列情况下,反应速率相同的是
A.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
B.等体积等浓度盐酸和醋酸分别与等质量的Na2CO3粉末反应
C.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与等体积0.2 mol/L NaOH液反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等质量、等品质的石灰石反应
13.已知反应:① 、2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②、稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol 下列结论正确的是 :
A.①的反应热为221 kJ/mol
B.碳的燃烧热大于110.5 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ
D.HCl和NaOH反应的中和热ΔH =-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热 ΔH =-114.6 kJ/mol
12.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①、用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②、用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③、2 s时物质A的转化率为70% ④、2 s时物质B的浓度为0.7 mol·L-1
其中正确的是
A.①③ B.①④ C.②③ D.③④
11.对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),△H <0下列叙述正确的是
4NO(g)+ 6H2O(g),△H <0下列叙述正确的是
A.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
B.若升高温度,正向反应速率增加,逆向反应速率减小
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
10.有一只50mL的酸式滴定管,其中盛有溶液,液面恰好在20mL刻度处,把管中的溶液全部放出,承接在量筒中的溶液体积是:
A、等于30mL D、等于20mL C、大于30mL D、小于30mL
9.用蒸馏水稀释l mo1/ L的醋酸时,始终保持增大趋势的是
A.溶液中的c(H+ ) B.溶液中的c(OH -)
C.溶液中的c(CH3COOH) D.溶液中的c(CH3COO-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com