
题目列表(包括答案和解析)
8.下列能跟氢原子形成最强极性键的原子是( )
A.F B.Cl C.Br D.I
7. 下列微粒中,最外层未成对电子数最多的是( )
A.O B.P C.Mn D.Fe3+
6.下列各原子或离子的电子排布式错误的是( )
A. Na+: 1s22s22p6 B. F :1s22s22p5
C. O2-: 1s22s22p4 D. Ar: 1s22s22p63s23p6
5.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A.+1 B.+2 C.+3 D.-1
4.下列各组元素中,电负性依次减小的是( )
A.K、Na、Al B.O、Cl、H C.As、P、H D.O、S、Cl
3.下列原子中,第一电离能最大的是( )
A.B B.C C.Al D.Si
2. 下列物质中,属于含有共价键的离子晶体是( )
A.CsCl B.KOH C.H2O D.H2
1.在物质结构研究的历史上,首先提出原子内有电子学说的科学家是( )
A.道尔顿 B.卢瑟福 C.汤姆生 D.波尔
22.(8分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知N2H4在氧气中完全
燃烧生成氮气和H2O,放出热量。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH
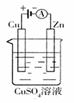 溶液。肼-空气燃料电池放电时:
溶液。肼-空气燃料电池放电时:
正极的电极反应式是 ,
负极的电极反应式是 ;
(2)右图是一个电化学过程示意图。
①锌片上发生的电极反应式是 ;
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论
上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
2008-2009学年度高二第二学期第一次段考
21.(10分)工业原料甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g) 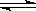 CO2(g)+3H2(g) △H > 0
CO2(g)+3H2(g) △H > 0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的反应速率为 ;
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号) ;
① v正(CH3OH) = v正(CO2) ② 混合气体的密度不变
③ 混合气体的平均相对分子质量不变 ④ CH3OH、H2O、CO2、H2的浓度都不再发生变化
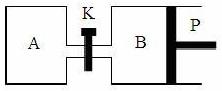 (3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度下,向A容器中充入1 mol CH3OH和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知,起始时容器A和B的体积均为a L。试回答:
(3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度下,向A容器中充入1 mol CH3OH和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知,起始时容器A和B的体积均为a L。试回答:
① 反应达到平衡时,容器B的体积为1.5 a L,B容器中CH3OH转化率为 ,A、B两容器中H2O(g)的体积百分含量的大小关系为B A(填“>”、“<”、“=” );
② 若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com