
题目列表(包括答案和解析)
21.(21分)
(1)前三周期元素中第一电离能最小的是___________ (填元素符号),其基态原子的电子排布式为______________________。第二周期非金属元素形成的氢化物中化学键极性最大的是__________(填分子式),该物质在CCl4中的溶解度比在水中的溶解度_______ (填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
|
代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
|
A |
邻-硝基苯酚 |
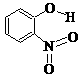 |
0.2 |
45 |
100 |
|
B |
对-硝基苯酚 |
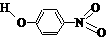 |
1.7 |
114 |
295 |
(3)晶格能的大小:MgO_________NaCl,键能的大小:HBr_______HI。(填“>”、“=”或“<”=
20.有关乙烯分子中的化学键描述正确的是 ( )
A.每个碳原子的sp2杂化轨道中的其中一个形成π键
B.每个碳原子的未参加杂化的2p轨道形成σ键
C.碳原子的三个sp2杂化轨道与其它原子形成三个σ键
D.碳原子的未参加杂化的2p轨道与其它原子形成σ键
19.以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型。下列分子属极性分子的是 ( )
A.H2O B.CO2 C.BCl3 D.CH4
18.用价层电子对互斥理论预测H2O和BF3的立体结构,两个结论都正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
17.在元素周期表中,原子最外电子层只有2个电子的元素是 ( )
A.一定是金属元素 B.一定是稀有气体元素
C.一定是过渡元素 D.无法判断是哪一类元素
16.下列分子中存在π键的是 ( )
A.H2 B.Cl2 C.N2 D.HCl
15.下列化合物中含有手性碳原子的是 ( )
A.CF2 B.
C.CH3CH2OH D.--COOH
14.下列物质的熔点高低顺序,正确的是 ( )
A.金刚石>晶体硅>碳化硅 B.CI4>CBr4>CCl4>CH4
C.NaF<NaCl<NaBr D.K>Na>Li
13.下列表达方式错误的是 ( )
A.
B.甲烷的电子式 
C.Cr原子的外围电子排布式 [Al] 2d44s2
D.碳-12 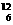 C
C
12.X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个,下列说法中正确的是 ( )
A.Y的单质是金属晶体
B.X的单质固态时为分子晶体
C.X能形成2种同素异形体
D.X与Y形成的化合物固态时为分子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com