
题目列表(包括答案和解析)
21.(10分)随着石油资源的日趋紧张,天然气
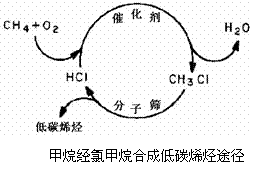 资源的转化利用越来越受到人们关注。由于
资源的转化利用越来越受到人们关注。由于
甲烷分子非常稳定,一般的活化方法需要大
量的热量。右图是最近研发出的天然气利用
新途径:甲烷首先在催化剂的作用下发生氧
氯化反应得到氯甲烷,再在400℃下通过分子
筛催化转化氯甲烷制取低碳烯烃。
请根据以上信息回答下列问题:
⑴ 写出一氯甲烷生成丙烯的化学反应方程式:_____________________________。
⑵ 请从工业生产角度说出一条甲烷经氯甲烷合成低碳烯烃的优点:______________。
⑶ 若该途径中第一步甲烷氧氯化反应的产率为80%,第二步反应生成的烯烃是乙烯、
丙烯、丁烯的混合气体,碳原子的利用率为90%。则:
①标准状况下1m3甲烷通过该途径可生成_______________Kg乙烯、丙烯、丁烯的混合气体。
②工业生产中将第二步反应生成的HCl分离后用于反应第一步合成氯甲烷,若在分离过程中有75%HCl被有效利用,试计算第二轮次反应投料时甲烷与需补充的HCl体积比。
20. (12分)呋喃丙胺是一种高效麻醉剂,在临床上被广泛使用,也可用于治疗心律失常。由呋喃甲醛合成呋喃丙胺的流程如下:
(12分)呋喃丙胺是一种高效麻醉剂,在临床上被广泛使用,也可用于治疗心律失常。由呋喃甲醛合成呋喃丙胺的流程如下:
已知: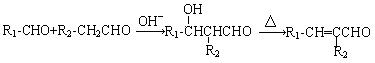
试回答下列问题:
⑴物质A的结构简式是 。反应①~⑤中属于取代反应的有 (填序号)。
⑵呋喃甲醛中碳原子的杂化方式为 ,分子中共平面的碳原子最多有 个。
⑶呋喃丙烯酸的同分异构体中属于醛类且含有酚羟基的结构共有 种。
⑷反应③的化学方程式为 。
⑸反应⑤的化学方程式为 。
19.(10分)目前工业上常采用天然气制备乙炔,再由乙炔进一步制备乙酸、维尼纶等化工原料,以下是以天然气为原料的各物质间的转化关系。
 已知:R-CN+2H2O+HCl→R-COOH+NH4Cl
已知:R-CN+2H2O+HCl→R-COOH+NH4Cl
请填空:
⑴乙炔的电子式为 。
⑵反应②是原子利用率100%的反应,所需另一反应物的分子式为_____________。
⑶写出反应⑥C2H4O和新制Cu(OH)2反应的化学方程式
。
⑷化合物C属于乙酸酯,且分子中含有碳碳双键,写出反应⑨的化学方程式
。⑸化合物C某种同分异构体属于酯类且含有五元环,其结构简式是 。
18.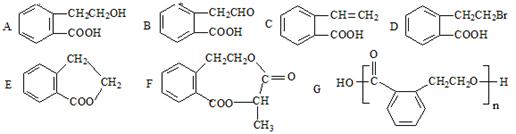 (10分)下列B~G均可由有机物A通过不同的反应制得。试回答下列问题:
(10分)下列B~G均可由有机物A通过不同的反应制得。试回答下列问题:
⑴A→C的反应的类型为:__________。A→E的反应的类型为:___________。
⑵在A-G七种物质中,互为同分异构体的是_________________(填代号,多选扣分,下同)。可看作酯类的是____________________。
⑶由A制取F时的另一反应物的结构简式为____________________________。
⑷请写出D的同分异构体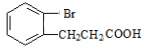 与足量NaOH溶液在一定条件下反应的化学方程式__________________________________________________________。
与足量NaOH溶液在一定条件下反应的化学方程式__________________________________________________________。
17.(8分)某研究性学习小组在实验室合成了一种物质A。
⑴经分析,A的相对分子质量不超过100,A中C、H的质量分数分别为:w(C)=69.76%,w(H)=11.63%,且完全燃烧后产物只有CO2和H2O。则A的摩尔质量为 。
⑵该兴趣小组同学对物质A结构进行了预测,其中不正确的是 (填序号)
A.可能含有一个碳环和一个醛基 B.可能含有一个碳碳双键和一个羟基
C.可能只含一个碳氧双键官能团 D.可能是环状的醚
⑶若A的核磁共振氢谱如下图所示,且A可以和金属钠反应生成H2,但不能在Cu作催化剂下被催化氧化。(提示:羟基与碳碳双键相连的结构不稳定)
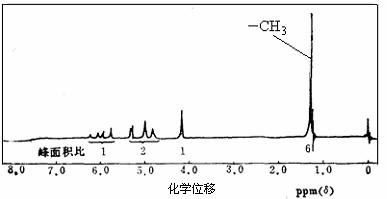
请根据以上信息写出A的结构简式 。
⑷A的某种同分异构体B分子中不含支链,能发生银镜反应。写出B发生银镜反应的化学方程式 。
16. (10分)⑴北京奥运会祥云火炬将中国传
(10分)⑴北京奥运会祥云火炬将中国传
统文化、奥运精神以及现代高科技融为一体。
火炬内熊熊大火来源于丙烷的燃烧,丙烷是
一种优良的燃料。试回答下列问题:
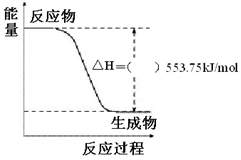
① 右图是一定量丙烷完全燃烧生成
CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:
___________________________________________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
⑵盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知: H2O(g)=H2O (l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l) △H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
②碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+ O2(g)
O2(g) CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有
。
CO(g)的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有
。
15.(12分)环己酮(微溶于水,易溶于醇和醚,沸点155.7℃)是一种重要的有机化工原料,主要用于制造己内酰胺和己二酸。实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):
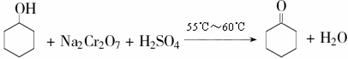 实验步骤如下:
实验步骤如下:
① 将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用。
② 在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀。控制瓶内温度在55℃-60℃之间,充分反应0.5h。
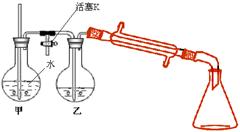 ③ 向②反应后的圆底烧瓶内加入少量水,
③ 向②反应后的圆底烧瓶内加入少量水,
并接入右图所示装置中,将T形管的活
塞K打开,甲瓶中有适量水,加热甲,
至有大量水蒸气冲出时关闭K,同时接
通冷凝水。
④ 将步骤③锥形瓶中收集到的液体分液,水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层。再向有机层中加入无水硫酸钠静置后转入干燥的圆底烧瓶中,进行蒸馏,除去乙醚后收集151℃-155℃馏分。
根据以上步骤回答下列问题:
⑴步骤①所得溶液分三次加入环己醇的原因是_____________________________。
⑵步骤③利用图示装置进行实验的目的是_________________,实验过程中要经常检
查甲中玻管内的水位。若玻管内的水位升高过多,其可能原因是________,此时应
立即采取的措施是_________________________。
⑶步骤④中加入无水硫酸钠的作用是_________,蒸馏除乙醚的过程中采用的加热方
式为____________________。
⑷写出该实验中可能发生的一个副反应的化学方程式_______________________。
14.α-鸢尾酮香料的分子结构如右图,下列说法正确的是
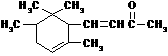 A.α-鸢尾酮的化学式为C14H24O
A.α-鸢尾酮的化学式为C14H24O
B.1molα-鸢尾酮最多可与3molH2加成
C.α-鸢尾酮能发生银镜反应
D.α-鸢尾酮既能发生氧化反应又能发生还原反应
第Ⅱ卷(非选择题 共72分)
13.下列说法正确的是
A.天然橡胶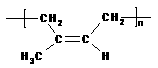 和杜仲胶
和杜仲胶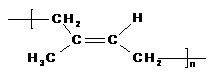
属于同分异构体
B.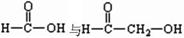 属于同系物
属于同系物
C.合成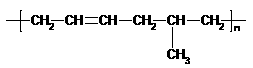 的单体为乙烯和2-丁烯
的单体为乙烯和2-丁烯
D.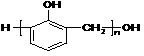 是由苯酚和甲醛发生加成反应后的产物脱水缩合而成
是由苯酚和甲醛发生加成反应后的产物脱水缩合而成
12.已知下列反应的热化学方程式:
⑴C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol
⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol
⑶H2(g)+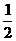 O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为
A.-488.3 kJ/mol B.+488.3 kJ/mol C.-244.15 kJ/mol D.+244.15 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com