
题目列表(包括答案和解析)
1.定义:当化学反应在一定的 下进行时,反应所 或 的热量称为在此温度下的 ,简称为反应热,其符号为 。当反应吸热时,反应热为 值;当反应放热时,反应热为 值。
20、一种澄清透明的溶液中可能含有下列离子:
K+、Fe3+、Ba2+、Al3+、NH4+、Cl-、I-、NO3-、HCO3-、SO32-、SO42-现做以下实验:
⑴将溶液滴在蓝色石蕊试纸上,试纸呈红色
⑵取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀
⑶将⑵中的沉淀过滤。由滤液中加入硝酸银溶液,产生白色沉淀
⑷另取溶液,逐滴加入氢氧化钠溶液至过量,只观察到有红棕色沉淀生成,且沉淀量不减少。由此可以推断:
溶液中肯定存在的离子有: 。
溶液中肯定不存在的离子有: 。
溶液中还不能确定是否存在的离子有: 。
19、准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
|
|
NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
第一次 |
0.01mL |
18.60mL |
|
第二次 |
0.20mL |
18.00mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3测出的盐酸浓度 (填“偏高”、“偏低”或不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? 填 “是”或“否”)
18、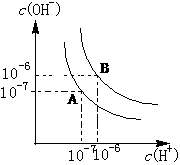 水的电离平衡如右图所示.
水的电离平衡如右图所示.
(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为 .
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 .
(3)已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱和溶液的密度为1g/mL,其离子积为 .
17、向含有Cl-、Br-、I-、Fe2+的溶液中,逐滴加入新制的溴水至足量,反应后溶液中离子数量明显减少的是 ;离子数量明显增多的是 ;离子数量基本不变的是 ;发生反应的离子方程式依次为 。
16、已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
A. 在Na2A、NaHA两溶液中,离子种类不相同
B. 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C. 在NaHA溶液中一定有:[Na+]+[H+]=[HA-]+[OH- ]+2[A2-]
D. 在Na2A溶液中一定有:[Na+]>[A2-]>[H+]>[OH- ]
15、下列各组离子在溶液中能大量共存的是( )
A.酸性溶液Na+、K+、MnO4-、Br- B.酸性溶液Fe3+、NH4+、SCN-、NO3-
C.碱性溶液Na+、K+、[Al(OH)4]-、SO42- D.碱性溶液Ba2+、Na+、CO32-、Cl-
14、下列离子方程式正确的是 ( )
A.FeBr2 溶液中加入过量氯水 2Fe2+ +Cl2 = 2Fe3++2Cl-
B.铁粉和FeCl3 溶液反应 Fe + Fe3+ = 2Fe2+
C.铁粉和过量的稀HNO3 反应 Fe +NO3-+4H+ = Fe3+ +NO↑+2H2O
D.Mg(HCO3)2 溶液 与过量 NaOH 溶液反应
Mg2++2HCO3-+2OH- = MgCO3↓+ CO32-+2H2O
13、将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性 B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性
12、相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是( )
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较两者产生氢气的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com