
题目列表(包括答案和解析)
1、考试时间:100分钟,满100分。
29.(9分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58克白色沉淀析出,向所得的浊液里逐滴加入1mol/L的盐酸,加入盐酸的体积及生成沉淀的质量如图所示,计算:
(1)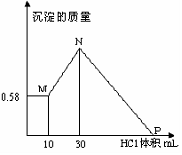 混合物中AlCl3的物质的量是多少?
混合物中AlCl3的物质的量是多少?
(2)P点所表示盐酸加入的体积是多少mL?
28.(12分)Ⅰ、根据右图回答下列问题:
⑴该仪器的准确名称是______________________。
⑵关于该仪器的叙述,不正确的是_______
A.其“0”刻度在上 B.精确度比量筒高
C.可量取KMnO4溶液 D.可量取NaOH溶液
⑶若该仪器的最大刻度为“25mL”,开始时液面控制在10mL处,
现将其中的液体全部放出,则收集到的液体体积_____。
A.小于10mL B.等于10mL C.等于15mL D.大于15mL
Ⅱ、用0.1000mol/LNaOH溶液滴定未知浓度的盐酸,进行以下滴定操作:
A.用蒸馏水洗净碱式滴定管,然后用标准NaOH溶液润洗,再将标准NaOH溶液装入碱式滴定管中,调整液面至零刻度线。
B.用酸式滴定管量取25.00mL盐酸于锥形瓶中,并滴加几滴酚酞指示剂。
C.在锥形瓶下垫一张白纸,滴定至终点,记下读数为20.00mL。
就此实验完成下列填空:
⑴滴定时眼睛应观察__________________ 。
⑵滴到终点,溶液的颜色由_____ ,且半分钟内不褪色。
⑶根据上述数据求得盐酸的物质的量浓度为______ mol/L。
⑷若开始时平视刻度读数,结束时俯视碱式滴定管刻度读数,则测定结果数值_____(填“偏高”、 “偏低”)。
27.(4分)实验室制氨气的反应方程式为
收集方法是: 。干燥剂:在干燥管中盛放 作干燥剂。
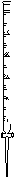
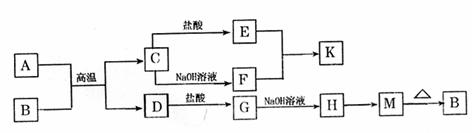 26.(10分)下图为中学化学中常见的物质转化关系图,其中A、D为单质,B为红棕色固体,K为白色胶状沉淀,即可以溶于强酸溶液,又可以溶于强碱溶液。
26.(10分)下图为中学化学中常见的物质转化关系图,其中A、D为单质,B为红棕色固体,K为白色胶状沉淀,即可以溶于强酸溶液,又可以溶于强碱溶液。
试回答:
(1)写出下列物质的化学式:F ;H 。
(2)
A+B反应的化学方程式 。
E溶液和F溶液反应的离子方程式: 。
H→M反应的化学方程式 。
24.(6分)在一定条件下,可逆反应:m A+n B  p C达到平衡,若:
p C达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡向 移动。
(3)加热后,可使C的质量增加,则正反应是 反应(填“放热”或“吸热”)。
25(8分)有两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;正、逆;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;正、逆;增大、减小、不变)。
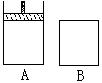 ⑴达到平衡所需要的时间:t(A) t(B),SO2的转化率:a(A) a (B)
⑴达到平衡所需要的时间:t(A) t(B),SO2的转化率:a(A) a (B)
⑵起始时两容器中的反应速率:v(A) v(B),
反应过程中的反应速率: v (A) v(B)。
⑶达到平衡时,在两容器中分别通入等量的Ar气。
A中的化学平衡向 反应方向移动,B中的化学反应速率 。
⑷达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的质量分数 ,B容器中SO2的质量分数 。
23. (4分)常温时,某溶液的PH=5,则溶液中由水电离出的c(H+)可能为 或
22. (4分) 配制FeCl2溶液时,既要加入少量 ,其作用是 ;又要加入少量 ,其作用
高温
21.(3分) 配平: V2O5 + A1 = V + A12O3
20.由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应生成的氢气在标准状况下为11.2L,则混合物中一定含有的金属是 ( )
A.锌 B.铁 C.铝 D.镁
卷Ⅱ(非选择题 共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com