
题目列表(包括答案和解析)
1.下列有关说法,正确的是( )
A.电解质溶于水一定放出热量
B.在一个确定的化学反应中,反应物总能量总是高于生成物总能量
C.可逆反应在加热时正逆反应速率都增大
D.在25℃时,0.01mol/L的氢氧化钠溶液中,水电离的c(H+)与水电离的c(OH-)的积为10-14
2.5g×80% m(KMnO4)
m(KMnO4)=2×158×2.5g×80%/(3×87)=2.4g(2分)
(4) 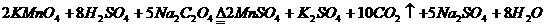
(5) 根据(4)中的化学方程式:
2KMnO4 5Na2 C2O4
2×158 5×134
m(KMnO4) 0.335g
m(KMnO4)=2×158×0.335g/(5×134)=0.158g
KMnO4纯度=(0.158g/0.165g)×100%=95.8%(4分)
标况下,在100 mL0.1mol·L-1某NaOH溶液中通入一定量CO2后,再向所得溶液
中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示。(假设生成的CO2全部逸出)。
求:(1)该稀盐酸物质的量浓度c(HCl)。
(2)滴加稀盐酸至50mL时共产生气体体积。
(3)滴加盐酸前溶液中所含溶质的成分及各自的物质的量浓度。
答案、(1)加入HCl 50mL时,溶液中刚好全生成NaCl
c(HCl)=0.1L×0.1mol·L-1/0.05L=0.2mol·L-1(2分)
(2)加入HCl 30mL后,发生的反应为NaHCO3+HCl=NaCl+H2O+CO2 ↑
所以V(CO2)=0.02L×0.2 mol/L×22.4L/mol=0.0896L(2分)
(3)从图像可知,第一阶段(无气体产生)耗去30mL盐酸大于第二阶段(产生气体并达最大量)耗去的20mL盐酸的体积,可知溶液中溶质的成分只能是NaOH、Na2CO3(2分) c(NaOH)=0.02mol·L-1(2分) c(Na2CO3)= 0.04mol·L-1(2分)
23、 (12分)实验室可由软锰矿(主要成分为MnO2制备KMnO4,方法如下:软锰矿与过量固
体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,
滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得
到深紫色的针状KMnO4。
请回答:
(1)软锰矿制备K2MnO4的化学方程式是 (2分);
(2)K2MnO4制备KMnO4的离子方程式是 (2分);
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程
式是 (2分);
(5)上述制得的KMnO4产品0.165g,恰好与0.335g钝Na2C2O4反应完全,计算该
KMnO4的纯度。
答案.(1)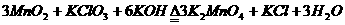
(2)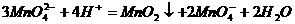
(3) 根据(1)和(2)中的两个方程式可以得到关系式:
3MnO2 2KMnO4
3×87 2×158
22、在标准状况下,将15.68L CO2和H2的混合气体(密度是相同状况下O2的0.25倍),充满一盛有足量Na2O2的密闭容器中,用不间断的电火花引发至充分反应,反应完全后下列叙述正确的是( B )
A.剩余0.6mol H2 B.固体增加了4g
C.剩余0.5molO2 D.生成0.1molNa2CO3和0.6molNaOH
21、.高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:
Fe(OH)3+ClO-+OH- 一FeO4 2-+Cl- +H2O(未配平),在上述反应中( D )
A.FeO4 2-是还原产物 B.ClO-是还原剂
C.1molFe(OH)3得到3mol电子 D.配平后OH- 的化学计量数为
20、下列说法不正确的是
A.1mol氧气含有12.04×1023个氧原子,在标准状况下占有体积约为22.4L
B.1mol臭氧和1.5mol氧气含有相同的氧原子数
C.等体积浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1
D.等物质的量的干冰和葡萄糖中所含碳原子数之比为1∶6,氧原子数之比为1∶3
19、据悉,北京奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞
击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为:
5KClO3 + 6P=3P2O5 + 5KCl ,则下列有关叙述错误的是( C )
A.上述反应中的生成物P2O5是酸性氧化物
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
18、IBr的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,也可与水发生如下反应:IBr+H2O=HIO+HBr,下列说法正确的是 ( AD )
A.IBr与Ca(OH)2反应,产物有CaBr2、Ca(IO)2和H2O
B.IBr与水反应,IBr既是氧化剂又是还原剂
C.IBr与钾反应,IBr既是氧化剂又是还原剂
D.IBr与铁反应,化学方程式是Fe+2IBr=FeI2+FeBr2
17、FeS2在空气中充分燃烧的化学方程式为4FeS2 + 11O2 2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为 (D )
A.120N/a B.120a/11N C.11a/120N D.120N/11a
16、已知反应:( B)
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是
A.①②③均是氧化还原反应
B.氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2
C.反应②中氧化剂与还原剂的物质的量之比为6∶1
D.反应③中0.1mol还原剂共失去电子数为1.2×1022
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com