
题目列表(包括答案和解析)
5.镭是元素周期表中第7周期ⅡA族元素,下列关于镭的性质的描述中不正确的是( )
A.在化合物中显+2价 B.单质遇水反应,放出H2
C.氢氧化物碱性比氢氧化钙弱 D.碳酸盐难溶
4.逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是( )
A.化合物都是由不同元素组成的,不同元素组成的物质一定是化合物
B.金属镁排在金属活动性顺序表中氢元素的前面,所以其与硝酸反应一定放出氢气
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物
3.下列各卤化物中,阴、阳离子的电子层结构都跟氖原子相同的是( )
A.MgF2 B.NaCl C.NaBr D.KI
2.下列关于元素周期表的说法正确的是( )
A.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除短周期外,其它周期均为18种元素
D.周期表中所有元素都是从自然界中发现的
1.下列用途主要体现铝的物理性质的是 ( )
①家用铝锅 ②盛浓硝酸的容器 ③制导线 ④焊接钢轨 ⑤包装铝箔 ⑥炼钢的脱氧剂
⑦做防锈油漆 ⑧做合金用作飞机制造业材料 ⑨工业做热交换器
A.①②③④⑤⑥ B.①②⑥⑦⑧⑨
C.①③⑤⑦⑧⑨ D.②③④⑥⑦⑧
22、在20℃时食盐的溶解度为36g,取一定量该温度下的饱和溶液用惰性电极进行电解,当阳极析出11.2L气体(标准状况)时,食盐恰好完全电解,所得溶液密度为1.20g·mL-1;试计算:
(1)阴极析出气体的质量。
(2)电解时,所取饱和食盐水的质量。
(3)电解后溶液中NaOH的物质的量浓度为多少。
菱湖中学2009学年第一学期
21、已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气燃烧的热化学方程式 。
(2)若1 molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为 890 kJ( 填“>”、 “<”、“= ”)。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时,则放出热量(Q)的取值范围是 。
20、工业上处理含Cr2O72-的酸性工业废水用以下方法:
①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,③过滤回收沉淀,废水达排放标准,试回答:
(1)电解时的电极反应,阳极 ,阴极
(2)写出Cr2O72-转变成Cr3+的离子方程式
(3)能否用Cu电极来代替Fe电极? 为什么?
19、依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。


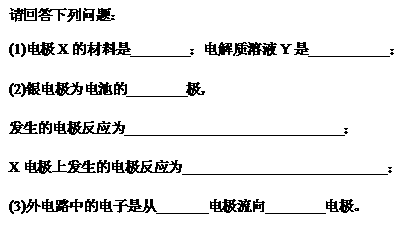
18、某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
|
实 验 用 品 |
溶 液 温 度 |
中和热 △H |
|||
|
t1 |
t2 |
||||
|
① |
50mL0.55 mol· L-1NaOH |
50mL0.5 mol· L-1HCl |
20℃ |
23.3℃ |
|
|
② |
50mL0.55 mol· L-1NaOH |
50mL0.5 mol· L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会
____(填“偏大”、“偏小”、“无影响”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com