
题目列表(包括答案和解析)
16.A原子示意图为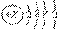 ,则X、Y及该原子3p能级上的电子数分别为( )
,则X、Y及该原子3p能级上的电子数分别为( )
A.18、6、4 B.20、8、6 C.26、14、6 D.15、3、1
15.下面关于晶体的叙述中,错误的是( )
A.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B.氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个
C.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
D.金刚石为网状结构,由共价键形成的碳原子环中,最小环 上有6个碳原子
上有6个碳原子
14.下列关于杂化轨道的说法正确的是( )
A.NCl3中心原子的杂化类型与SO32-不相同
B.凡是AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键
C.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
D.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道
13.下列叙述正确的是( )
A.同一周期元素的原子,半径越小,越容易失去电子
B.同一主族的元素,原子半径越大,其单质的熔点一定越高
C.同一主族元素的氢化物,相对分子质量越大,它的沸 点一定越高
点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
12.下列说法中错误的是( )
A.在NH4+和[Cu(NH3)4]2+中都存在配位键
B.原子晶体的熔点一定比金属晶体的高
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点 高、硬度大的特性
高、硬度大的特性
11.某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素原子的最外层电子排布是( )
A.2s22p3 B.2s22p5 C.3s23p3 D.3s23p5
10. 下列说法中正确的是( )
下列说法中正确的是( )
A.氢键是一种特殊类型的化学键 B.氯化钠熔化时离子键被破坏
C.冰熔化时水分子中共价键发生断裂 D.晶体中分子间作用力越大,分子越稳定
9.下列各组物质熔化或升华时,所克服的粒子间作用力属于同种类型的是( )
A.Mg和S熔化 B.Na2O和SiO2熔化
C.碘和干冰升华 D.氯化钠和蔗糖熔化
8.下列分子或离子的中心原子的VSEPR构型为正四面体而分子或离子的空间构型为V型的是( )
A.CO2 B.H3O+ C.BeCl2 D.OF2
7.下列分子中,所有原子的最外层均为8电子结的是( )
A.NH3 B.BF3 C.SF3 D.NCl3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com