
题目列表(包括答案和解析)
7.在常温常压下,取下列4种气态烃各1mol.分别在足量氧气中燃烧,消耗氧气最多的是( )
A.甲烷 B.乙烯 C.乙炔 D.丙烷
6.下列物质中,能用酸性高锰酸钾鉴别的是( )
A.苯、乙炔 B.乙烯、乙炔 C.苯、甲烷 D.甲苯、乙炔
5.下列物质中,既能发生加成反应,也能发生取代反应,还能使酸性高锰酸钾溶液褪色的是( )
A.氯仿 B.苯 C.甲苯 D.乙烷
4.下列各对物质中,互为同分异构体的是( )
A.CH3-CH2-CH2-CH3和CH3-CH=CH-CH3 B.CH3-CH=CH-CH3和CH3-C(CH3)=CH2
C.CH3-CH=CH-CH3和CH3-CH=C(CH3)-CH3 D.CH2=CH-CH2-CH3和CH3-CH2-CH=CH2
3.下列各组内的物质不属于同系物的是( )
A.CH3-CH3 (CH3)2CH-CH2-CH3
B.CH3CH=CH2 CH3CH=CHCH3
C.CH3-CH2-OH CH3-CH2-CH2-CH3
D.CH3COOH (CH3)2CHCOOH
2.在光照条件下,将等物质的量的甲烷和氯气充分混合反应后,得到产物物质的量最多的是( )
A.CH3Cl B﹒CHCl3 C﹒CCl4 D﹒HCl
1.下列关于烃的说法中,正确的是( )
A.烃是指分子里含有C、H的化合物
B.烃是指分子里含有碳元素的化合物
C.烃是指燃烧后生成CO2和H2O的化合物
D.烃是指仅有C、H两种元素组成的化合物
29.(13分)等电子体原理是指两个或两个以上的分子(或离子),它们的原子数相同,分子(或离子)中价电子数也相同,等电子体具有相似的电子结构、几何构型和性质。下表为部分元素等电子体的分类、空间构型表。
|
等电子体类型 |
代表物质 |
空间构型 |
|
四原子24电子等电子体 |
SO3 |
平面三角型 |
四原子26电子 等电子体 等电子体 |
SO32- |
三角锥型 |
|
五原子32电子等电子体 |
CCl4 |
四面体型 |
|
六原子40电子等电子体 |
PCl5 |
三角双锥型 |
|
七原子48电子等电子体 |
SF6 |
八面体型 |
请回答下列问题:
(1)指出下列物质离子、分子的空间构型:
BrO3- ,CO32- ,HClO4 ;
(2)由第一、二周期元素组成,与F2互为等电子体的离子是 (写一种),有机分子是 、 (写两种);
(3)双原子14电子的等电子体共同特点是物质中都具有共价叁键,请举出相应的3个例子
(分子或离子),每个分子或离子中含 个σ键, 个π键;
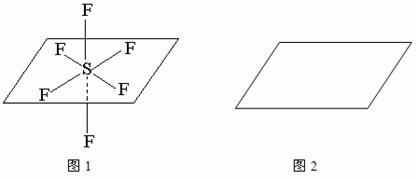
(4)SF6的空间结构如图1所示,请按照图1表示方法,在图2中表示OSF4分子中O、S、F原子的空间位置。已知OSF4分子中O、S间为共价双键,S、F间为共价单键。
28.(9分)已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充 满。A+ 比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
满。A+ 比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为 。
(2)C的氢化物分子是 (填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是 。
(4)E元素原子的核外电子排布式是 ;E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为 ;E(CO)5中的配体CO与N2、CN-等互为等电子体,写出CO分子的结构式 。
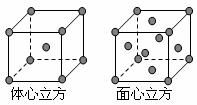
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个 数之比为
。
数之比为
。
27.(10分)某离子晶体晶胞结构如右图所示,X位于立方体的顶点,Y位于立方体中心。试分析:
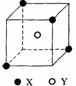 (1)晶体中每个Y同时吸引着 个X,每个X同时吸引 着个Y,该晶体化学式为 ;
(1)晶体中每个Y同时吸引着 个X,每个X同时吸引 着个Y,该晶体化学式为 ;
(2)晶体中在每个X周围与它最接近且距离相等的X共有 个;
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为 (填角的度数);
(4)设该晶体的摩尔质量为M
g/mol ,晶体密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个距离最近的X之间的距离为 cm3。
,晶体密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个距离最近的X之间的距离为 cm3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com