
题目列表(包括答案和解析)
14.今用铝、稀硫酸和NaOH溶液为原料,在实验室制备一定量的Al(OH)3。可分别采用下列化学方程式所表示的两种方法:
①2Al+3H2SO4=A12(SO4)3+3H2↑
Al2(SO4)3+6NaOH=2A1(OH)3↓+3Na2SO4
②2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2NaAlO2+H2SO4+2H2O=2Al(OH)3+↓Na2SO4
(1)上述哪一种方法比较节约试剂?(提示:试从每生产2molAl(OH)3所耗费的试剂用量加以说明)
__________________________________________________________________。
(2)原料相同,请设计一个更为节约试剂的方法(以方程式表示并说明可以更节约试剂的根据)
_____________________________________________________________________________。
答案:(1)第②种方法比较节约试剂。同样制备2molAl(OH)3,方法①需要2m01Al,3molH2SO4,6mol
NaOH;而方法②只需2molAl,1mol H2SO4,2molNaOH
(2)2Al+3H2SO4=A12(SO4)3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑
A12(SO4)3+6NaAlO2+12H2O=8Al(OH)3↓+3Na2SO4
由方程式可以看出,制备2molAl(OH)3,所需试剂的用量为2molAl,0.75molH2SO4,1.5molNaOH,其试剂的用量最少
13.有一透明溶液,可能会有较大量的NH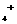 、Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO
、Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO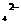 、CO
、CO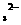 中的一种或几种,取此溶液做下列实验:
中的一种或几种,取此溶液做下列实验:
①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
 ②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色、无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图4-1所示,推断:
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色、无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图4-1所示,推断:
(1)溶液中一定会有的离子是___________;
(2)溶液中肯定不含有的离子是___________;
(3)可能含有的离子是___________。
答案:(1)Mg2+、Al3+、H+、SO42- (2)CO32-、NH4+、Cu2+、Fe3+ (3)Na+
12.为了除去铝土矿中少量的Fe2O3和SiO2等杂质,得到纯净的A12O3,其操作过程如下:
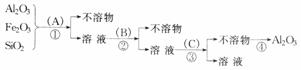
分析以上各步操作,回答:(1)试剂A是_____________________,试剂B是___________。
(2)操作①为过滤,如果没有此操作,直接进入操作②,对后面操作会产生什么影响?
_____________________________________________________________________________。
答案:(1)盐酸;NaOH溶液 (2)①中不溶物SiO2在操作②中会被NaOH溶解
11.拉曼光谱证实,溶液中不存在AlO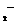 ,却存在Al(OH)
,却存在Al(OH)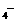 离子,写出A1C13与过量NaOH溶液作用的化学方程式__________________,Al与烧碱溶液反应的离子方程式______________________。
离子,写出A1C13与过量NaOH溶液作用的化学方程式__________________,Al与烧碱溶液反应的离子方程式______________________。
答案:AlCl3+4NaOH=NaAl(OH)4+3NaCl
2Al+6H2O+2OH-=2Al(OH)4-+3H2↑
10.将一个用金属铝做的易拉罐内充满CO2,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口。经过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪的罐又重新鼓起来。
(1)罐壁内凹而瘪的原因是___________________________,反应的化学方程式为____________________________________。
(2)罐重新鼓起来的原因是___________________________,反应的化学方程式为_____________________________________________。
答案:(1)CO2与NaOH溶液反应使罐内气体压强减小;CO2+2NaOH=Na2CO3+H2O
(2)Al和NaOH溶液反应生成H2,而使罐内气体压强增大;2Al+2NaOH+2H2O=2NaAlO2+3H2v↑
9.点燃的镁条在SO2中燃烧与在CO2中燃烧相似,但比镁在CO2中燃烧更为剧烈。反应结束后,在盛有SO2的广口瓶中可能存在的生成物是_________,反应的化学方程式为_________。
答案:MgO、S;2Mg+SO2 2MgO+S
2MgO+S
8.在Ah(SO4),、K2SO4、KAl(SO4)2的混合溶液100mL。中,如果SO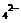 的浓度等于0.4mol/L,当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )。
的浓度等于0.4mol/L,当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )。
A.0.2m01/L B.0.05mol/L C.0.45mol/L D.0.225mol/L
答案:B
7.以下各组均含有三种溶液,这三种溶液所含溶质的物质的量均相等,将它们充分混合后,不会产生沉淀的是( )。
A.AlC13、Ba(OH)2、HCI B.BaCl2、Na2CO3、HCl
C.MgCl2、NaOH、HNO3 D.NaAlO2、NaOH、H2SO4
答案:C
6.为了除去KCl中少量的MgSO4和CaCl2杂质,需进行下列5项操作:①加入KOH溶液;②加入盐酸;③加入BaCl2溶液;④过滤;⑤加入Na2CO3溶液,先后顺序正确的是( )。
A.①③⑤④② B.①⑤③④② C.①③④⑤② D.①②⑤③④
答案:A
5.在等体积的相同浓度的H2 SO4 溶液中,分别加入足量的①Mg粉 ②MgO ③Mg(OH)2 ④MgCO3,充分反应后得到MgSO4溶液的物质的量浓度相同的是( )。
A.①③ B.①② C.②④ D.③④
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com