
题目列表(包括答案和解析)
16.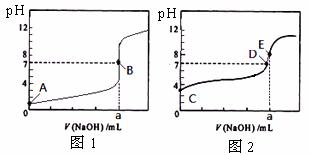 常温下,用0.1000 mol/L
NaOH溶液分别滴定20.
00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。若以HA表示酸,下列说法正确的是
常温下,用0.1000 mol/L
NaOH溶液分别滴定20.
00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。若以HA表示酸,下列说法正确的是
A.滴定醋酸的曲线是图1
B.达到B、E状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C.达到B、D状态时,反应消耗的n(CH3COOH)<n(HCl)
D.当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-) >c(Na+)> c(H+) > c(OH-)
15.室温下,下列叙述正确的是(溶液体积变化忽略不计)
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
|
pH |
11 |
11 |
3 |
3 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均减小
B.分别将等体积的③和④加水稀释后溶液的pH相同,加入水的体积:③<④
C.①、④两溶液等体积混合,所得溶液中c(C1-)>c(NH4+)>c(OH-)>c(H+)
D.②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+)
14.下列根据反应原理设计的应用,不正确的是( )
A.CO32- + H2O
 HCO3-+ OH错误!链接无效。 热的纯碱溶液清洗油污
HCO3-+ OH错误!链接无效。 热的纯碱溶液清洗油污
B.Al3+ + 3H2O  Al(OH)3 +3H+ 明矾净水
Al(OH)3 +3H+ 明矾净水
C.TiCl4
+(x+2)H2O(过量)  TiO2·x H2O↓ +
4HCl 用TiCl4制备TiO2
TiO2·x H2O↓ +
4HCl 用TiCl4制备TiO2
D.SnCl2 + H2O 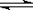 Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
13.下列按电负性减小顺序排列的是
A. N、O、F B. N、P、As C. K、Na、Li D. Cl、O、H
12.下列化合物中只含有2个手性碳原子的是
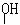
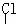
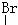 A.OHC-CH-CH2-OH B.OHC-CH-CHCl
A.OHC-CH-CH2-OH B.OHC-CH-CHCl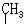
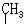
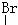
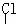
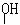
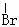
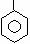 C.HOOC-CH-C-CHCl D.CH3-CH-C-CH2-CH3
C.HOOC-CH-C-CHCl D.CH3-CH-C-CH2-CH3
11.“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。下列说法合理的是
A.依据等电子原理N2O与SiO2分子具有相似的结构(包括电子式)
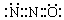 B.已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示
B.已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示
C.N2O与CO2互为等电子体,因此不含非极性键。
D.N2O为 角形分子
10.以下微粒含配位键的是:
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤NH3 ⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2OH
A.①②④⑦⑧ B ①④⑥⑦⑧ C.③④⑤⑥⑦ D.全部
9.某些化学键的键能数据如下表所示(kJ·mol-1):
|
键 |
H-H |
Br-Br |
I-I |
Cl-Cl |
H-Cl |
H-I |
H-Br |
|
键能 |
436 |
193 |
151 |
247 |
431 |
299 |
356 |
分析上表中数据,下列结论正确的是
A.把1mol Cl2分解为气态原子时,需要放出247 kJ能量
B.由表中所列化学键形成的单质分子中,最稳定的是H2 ,形成的化合物分子中,最不稳定的是HI
C.在一定条件下,1mol H2 与足量的Cl2 、Br2 、I2 分别反应,放出热量由多到少的是
I2 > Br2 > Cl2
D.预测1mol H2 在足量F2 中燃烧比在Cl2中放热少
8.甲醛,分子式CH2O,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质。下列关于其结构及性质的分析正确的是
A.C原子采取sp3杂化,O原子采取sp杂化
B.甲醛分子中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构
C.甲醛分子与水分子间可以形成氢键,甲醛分子间不能形成氢键
D.甲醛分子为非极性分子
7.气态电中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
A.1s22s22p63s23p2→1s22s22p63s23p1 B.1s22s22p63s23p3→1s22s22p63s23p2
C.1s22s22p63s23p4→1s22s22p63s23p3 D.1s22s22p63s23p64s24p2→1s22s22p63s23p64s24p1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com