
题目列表(包括答案和解析)
6.同温同压下,下列各组热化学方程式中,△H1﹤△H2的是
A.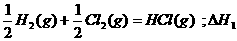
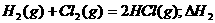
B.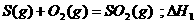
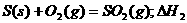
C.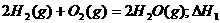
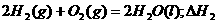
D.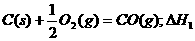
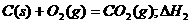
5.在水溶液中YO3n-与S2-发生反应的离子方程式如下:YO3n- + 3S2-+ 6H+ =Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和Y元素原子的最外层电子数分别是
A.+5、4 B.+5、7 C.+5、5 D.+7、7
4.下列过程没有破坏化学键的是
A.2O3 = 3O2 B.干冰升华 C.NaCl晶体受热融化 D.HCl气体溶于水
3.下列叙述正确的是
A.离子化合物中不可能存在非极性键
B.非极性分子中不可能既含极性键又含非极性键
C.非极性分子中一定含有非极性键
D.不同的非金属元素原子之间形成的化学键都是极性键
2.NA表示阿伏加德罗常数的值,下列说法正确的是
A.室温下,32gO2和O3的混合气体中氧原子数为2NA
B.将80gNaOH 固体溶解在1L的水中,所得溶液中NaOH的物质的量浓度为2mol/L
C.22.4L的O2中一定含有NA个氧分子。
D.标准状况下,22.4L的HI气体中,H+数为NA
1.06年9月25日正式结束的西藏萨迦寺文物考古工作,共挖掘出元、明、清时期的各类文物900余件。在考古工作中用的较多的是13C和15N的分析方法。下列关于13C和15N的叙述正确的是
A.13C与15N具有相同的中子数
B.0.012kg 13C所含的碳原子数为阿伏加德罗常数
C.等物质的量的13C17O和15N2 ,两气体具有相同的质子数、原子数和质量
D.13C、15N和C60、N70互为同位素
16.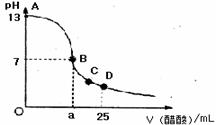 在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的
在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的
A.在A、B间任一点,溶液中一定都有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有
c(Na+)==c(CH3COO-)=c(OH-)==c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)十c(CH3COOH)==2c(Na+)
请将以上答案填入以下空格内
15.恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应3A(g) + 2B(g)  2C(g)
+ xD(s) 的化学平衡状态,相关数据如下:
2C(g)
+ xD(s) 的化学平衡状态,相关数据如下:
M:3molA 2molB; 2min达到平衡,生成D1.2mol,测得从反应开始到平衡C的速率0.3mol·L-1·min-1
N:2molC ymolD; 达到平衡时c(A)=0.6mol·L-1。
下列推断的结论中不正确的是
A.x=2 B.平衡时M中c(A)﹤0.6mol·L-1
C.y﹥0.8 D.y﹤0.8
14.将多磷酸钠溶液通过氢型阳离子交换柱,进行Na+与H+的交换,得到多磷
酸,其结构为:

交换后的溶液用0.1mol·L-1的NaOH溶液滴定。在消耗NaOH溶液42.00mL和50.00mL时各有一个滴定终点。则下列判断正确的是
A.两端的__OH上的氢难电离 B.中间链上的__OH上的氢难电离
C.所有的__OH上的氢电离能力都一样 D.无法判断哪一部分__OH上的氢难易电离
13.四种主族元素的离子aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素的原子序数),
它们具有相同的电子层结构,若m>n,则下列关系能够成立的是
A. 原子序数:a>b>c>d B. a-b=n-m
C.元素非金属性:Z<R D.最高价氧化物对应水化物的碱性:X>Y
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com