
题目列表(包括答案和解析)
21.(6分)下图表示的反应关系中,部分产物被略去,已知1mol白色固体粉末X完全分解后,恢复到室温,生成白色固体A,无色液体B,无色气体C各1mol,E、X、G的焰色反应均为黄色。
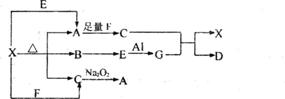
请回答下列问题:
(1)写出下列物质的化学式:X: G: D:
(2)写出G与C反应的化学方程式
(3)写出X+E→A的离子方程式
20.(16分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)。
__________________________________________________________________________
。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:

(1)甲装置常常浸在70-80℃的水浴中,目的是_______________________________。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热
状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结
束。
①乙醇的催化氧化反应是_________反应(填“放热”或“吸热”),该反应的化学方程
式为________________________________________。
②控制鼓气速度的方法是_____________________________,若鼓气速度过快则会
_________________________,若鼓气速度过慢则会________________________。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填
戊装置中导管代号):乙接______、______接丙;若产物不用水吸收而是直接冷却,
应将试管丁浸在_________中。
19.(6分)在常温、常压下,注射器甲中装有NO2气体,
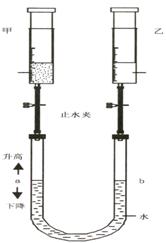 注射器乙中装有同体积的空气(如图所示,夹持仪器
注射器乙中装有同体积的空气(如图所示,夹持仪器
均已略去)。
(1)常温下,打开两个止水夹后,同时向外拉动两注
射器的活塞,且拉动的距离相同,将会看到U型
管中液面a (升高、下降、
不变),试解释这一现象 (二
氧化氮不与水接触)。
(2)如将注射器甲中的气体换成NH3,仍在常温下,
打开两个止水夹后,同时向里推动两注射器的
活塞,且推动的距离相同,将会看到U型管中
液面a (升高、下降、不变),
试解释这一现象 ______ ______。
18.已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2mol SO2、1mol O2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是 ( )
A.向甲容器中充入一定量的氦气 B.向乙容器中充入一定量的SO3气体
C.升高乙容器的温度 D.增大甲容器的压强
第Ⅱ卷(非选择题,共78分)
17.阴离子Xn-含有N个中子,X的质量数为A, 则Wg X元素的气态氢化物中含有质子的物质的量为(单位mol): ( )
A.A(n-N)/W B.A(n-N)/(W+A)
C.A(W+n)/(W+N) D. W(A-N+n)/(A+n)
16.下列离子方程式,正确的是 ( )
A.SO2气体通入Ca(ClO)2溶液中:H2O+SO2+Ca2++2ClO-=CaSO3↓+2HClO
B.室温时向NaHSO4 溶液中逐滴加入Ba(OH)2溶液到中性:
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
C.向100mL、1mol·L-1的FeI2溶液中通入标准状况下的Cl22.24L 2Fe2++Cl2=2Fe3++2Cl-
 D.用铂作电极电解MgCl2溶液: 2Cl-+2H2O H2↑+Cl2↑+2OH-
D.用铂作电极电解MgCl2溶液: 2Cl-+2H2O H2↑+Cl2↑+2OH-
15.已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
( )
A.Al3+、Mg2+、Cl- B.CH3C00-、Ba2+、Br-
C.Mg2+、Cl-、I- D.Na+、NH4+、Cl-
14.下列除去杂质的实验方法正确的是 ( )
A.除去CO中少量O2:通过灼热的Cu网后再收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤
D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
13.设阿伏加德常数为NA。则下列说法正确的是 ( )
A. 常温常压下,11.2L甲烷中含有的氢原子数为2NA
B. 标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
12.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是 ( )
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+
2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com