
题目列表(包括答案和解析)
21.(8分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式 、
、 。
(2)C与D形成D的最低价化合物的电子式: 。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因: 。
20.(14分)“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”。若产生的气体为N2O,稀硝酸腐蚀锌版反应的主要化学方程式是
。
“烂版液”另外含有由自来水带进的Cl-、Fe3+等杂质离子。
已知Fe3+开始沉淀的pH为2.7,沉淀完全的pH为3.7。
在实验室中,由“烂版液”制取ZnSO4·7H2O的过程如下:
① 在“烂版液”中逐渐加入6mol·L-1NaOH溶液,用pH试纸检验,至pH=8为止。
② 过滤后得到Zn(OH)2沉淀(该沉淀可溶于pH>8的溶液),用去离子水多次洗涤沉淀。
③ 用2mol·L-1的硫酸,慢慢将洗净的Zn(OH)2溶解,保持一定的pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
④ 溶液中注入2 mol·L-1的硫酸,使其pH保持为2,将溶液小心加热,冷却后即得到ZnSO4·7H2O晶体。
在操作①中保持pH=8的目的是 。
Cl-、NO3-是在操作 中除净的。
操作③中加热的目的是 。
Fe3+是在操作 中除去的。
操作④保持pH=2的目的是 。
操作④加热过程中所用的主要仪器是
。
19.(6分)用32%~35%的FeCl3溶液腐蚀印刷线路铜板的废液中含有FeCl3 、FeCl2和CuCl2。
(1) 回收铜的化学方法为:
。
(2) 回收铜以后的溶液如何利用?
。
18. 如图所示,温度不变时某容器分隔成A、B两部分,A、B之间挡板可以左右自由移动,
B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3(g)和lmolN2,
在相同温度和压强的条件下发生可逆反应:2SO2(g)+O2(g) 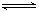 2SO3(g)下列说法正确的是:
2SO3(g)下列说法正确的是:
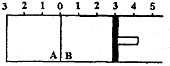 A.平衡后A、B两容器的体积比为1:2
A.平衡后A、B两容器的体积比为1:2
B. 平衡后A、B两容器中的SO3体积分数相等
C.平衡后A、B两容器中的SO2转化率相等
D. 平衡后容器中SO2的物质的量:A<B
 第II卷(非选择题 共76分)
第II卷(非选择题 共76分)
17.第VA族元素的原子(以R表示)与A原子结合形成RA3气态分子,其空间构型呈三角锥形。PCl5 在气态和液态时,分子结构如图所示,下列关于PCl5 分子的说法中不正确的是
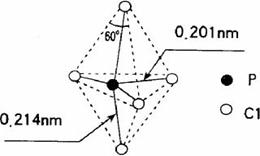 A.每个原子都达到8电子稳定结构
A.每个原子都达到8电子稳定结构
B.键角(∠ClPCl)有90o、120o、180o几种
C.PCl5 受热后会分解生成分子空间构型呈三角锥形的 PCl3
D.分子中5个P-Cl 键键能不都相同
16.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中错误的是
A.由Al、Cu、稀硫酸组成的原电池,其正极反应式为:2H++2e-= H2↑
B.由Al、Mg、NaOH溶液组成的原电池,其负极反应式为:Mg-2e- = Mg2+
C.由Fe、Cu、FeCl3 溶液组成的原电池,其正极反应式为:Fe3++e- = Fe2+
D.由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e- = Cu2+
15.下列叙述正确的是
A.某可溶物的摩尔质量大于18g/mol,则该物质饱和溶液的密度一定大于1g/cm3
B.氯化钠饱和溶液的质量分数为a%,该温度下氯化钠的溶解度为Sg,则a一定小于S
C.将质量分数分别为90%与10%的H2SO4等体积混合,其质量分数一定等于50%
D.饱和KCl溶液密度为ρg/cm3,物质的量浓度为c mol/L,则KCl的质量分数为(74.5c/1000ρ)×100%
14.气态原子生成+1价气态阳离子所需要的能量称为第一电离能。元素的第一电离能是衡量元素金属性强弱的一种尺度。下列有关说法不正确的是
A.元素的第一电离能越大,其金属性越强
B.元素的第一电离能越小,其金属性越强
C.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
D.金属单质跟酸反应的难易,除跟该金属元素的第一电离能有关外,还与该单质中固态金属原子以及该金属原子失去电子后在水溶液里形成的水合离子的行为有关
13.下列各组离子在指定溶液中,能大量共存的是
①无色溶液中:K+,Cl-,Na+,HPO42-,PO43-,SO42-
②PH=11的溶液中:CO32-,Na+,AlO2-,NO3-,S2-,SO32-,ClO-
③水电离出的H+浓度C(H+)=10-12mol·L-1的溶液中:Cl-,HCO3-,NO3-,NH4+,S2O32-
④加入铝能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-,NO3-
⑤酸性溶液中:Fe2+,Al3+,NO3-,I-,Cl-,S2-
A.①②④ B.①②③ C.①② D.①
12. 若将224 mL标准状况下的Cl2通入5mL 2mol/L的FeBr2溶液中,发生反应的离子方程式是
A.Cl2+2Br-=Br2+2Cl- B.Cl2+2Fe2+=2Fe3++2Cl-
C.2Cl2+2Br-+2Fe2+=2Fe3++Br2+4Cl- D.3Cl2+4Br-+2Fe2+=2Fe3++2Br2+6Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com