
题目列表(包括答案和解析)
9、羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已知:FeSO4+ KMnO4+ H2SO4= Fe2(SO4)3+ K2SO4+ MnSO4+ H2O(未配平)),则在上述反应中,羟胺的氧化产物是( B )
(A)N2 (B)N2O (C)NO (D)NO2
高考重要考点三:热化学方程式的书写及正误判断;有关热化学方程式的简单计算
8、24mL0.05mol/L的Na2SO3溶液恰好与20mL0.02mol/L的K2Cr2O7溶液恰好完全反应,则在还原产物中铬元素的化合价是( B )
(A)+6 (B)+3 (C)+2 (D)0
7、某FeCl2 溶液中混有FeI2 杂质,根据已知反应:①2FeCl3+2KI=2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3;③F2+2KI(固)=2KF+I2中的有关事实,要除去其中的FeI2,应选用的试剂是( C )
(A)F2 (B)过量Cl2 (C)FeCl3 (D)FeCl2
6、已知 I-、Fe2+、SO 2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为 Cl-< Fe 2+< H2O 2 < I-< SO 2,则下列反应不能发生的是( CD)
(A)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ (B)I2+SO2+2H2O=H2SO4+2HI
(C)H2O2+H2SO4=SO2+O2+2H2O (D)2Fe2++I2=2Fe3++2I-
5、常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是( C )
(A)②④⑥ (B)①③④ (C)①③⑤⑥ (D)②⑤
4、下列有关阿伏加德罗常数的叙述正确的是( A )
(A)标准状况下,以任意比混合的甲烷和丙烷混合气体22.4L所含分子数为NA个
(B)1mol冰醋酸中含有6.02×1023个CH3COO-
(C)电解饱和食盐水时,每得到1molNaOH,在阳极反应的离子就得到1mol电子
(D)标准状况下,1L辛烷完全燃烧后所生成气态产物的分子数为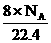
高考重要考点二:氧化还原反应(包括氧化还原反应的基本概念;氧化性还原性强弱的判断;
根据得失电子守恒推断氧化产物或还原产物;配平氧化还原反应的方程式并标出电子转移的
方向和数目)
3、下列有关阿伏加德罗常数的叙述正确的是( BC )
(A)1mol Na2O2与足量水蒸气反应转移电子数为2×6.02×1023个
(B)1mol碳酸钠溶于水所得溶液中所含阴离子数大于0.1×6.02×1023个
(C)25℃时,1g水中约含有6.02×1013个OH-
(D)1molSiO2晶体中约含2×6.02×1023个Si-O键
2、下列有关阿伏加德罗常数的叙述正确的是( BC )
(A)17g OH-含有9×6.02×1023个电子
(B)标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
(C)106g碳酸钠固体中含有6.02×1023个阴离子
(D)标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
1、NA代表阿伏加德罗常数值,下列说法正确的是( D )
(A)9g重水所含有的电子数为5NA
(B)1molMgCl2中含有离子数为NA
(C)7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
(D)1molC10H22分子中共价键总数为31NA
47、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是( C )
A.负极反应为14H2O+7O2+28e-====28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com