
题目列表(包括答案和解析)
25.(12)以石油产品乙烯为超始原料进行合成高分子化合物F和G,下图所示为合成路线图:
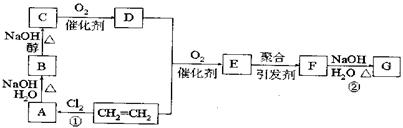
|
 CH2=CH2+CH3COOH
C4H6O2(醋酸乙烯酯)
CH2=CH2+CH3COOH
C4H6O2(醋酸乙烯酯)
|
|
|
 CH3CH2Cl
CH2==CH2+HCl
CH3CH2Cl
CH2==CH2+HCl
|
 CH3CH2Cl+H2O
CH3CH2OH+HCl
CH3CH2Cl+H2O
CH3CH2OH+HCl
又知:与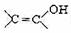 结构相似的有机物不稳定,发生分子重排生成
结构相似的有机物不稳定,发生分子重排生成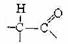
请回答下列问题:
(1)写出结构简式:E: F:
(2)反应①、②反应类型:① ②
(3)写出A→B、B→C的化学方程式:
A→B: B→C:
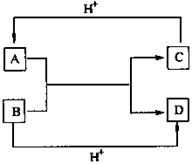
24.(9分)已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下转化关系:
(1)如果A、B、C、D均是10电子的微粒,请写出:
A的结构式 ;
D的电子式 。
(2)如果A和C是18电子的微粒,B和D是10电
子的微粒,请写出:
①A与B在溶液中反应的离子方程式 ;
②根据上述离子方程式,可以判断C与B结合质子的
能力大小是(用化学式或离子符号表示):
> 。
(3)已知肼(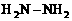 )和甲胺(
)和甲胺(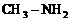 )都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
。
)都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
。
23.为测定碳酸钙纯度(设含杂质SiO2),某学生设计了如下几个实验方案,请回答每个方案中的问题:
方案I:(1)称取碳酸钙样品mg。(2)加入过量盐酸 (3)收集并测定生成气体体积Vml。
问题a:如果你称量样品时,砝码底部有一处未被人发现的残缺,那么测得的碳酸钙纯度会偏 (填高、低、无影响)
方案II(1)称取碳酸钙样品mg(2)高温煅烧1000℃直至质量不再改变,冷却后称量质量为m′g。
问题b:如何确定质量已不再改变?
问题c:本方案中应如何“冷却”?
方案III(1)称取碳酸钙样品mg。(2)用Cmol·L-1盐酸Vml(过量)溶解样品,(3)取溶解后溶液的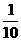 ,用
,用 mol·L-1 NaOH溶液滴定恰好用去
mol·L-1 NaOH溶液滴定恰好用去 ml。
ml。
问题d:列出本实验中还需用到的试剂、仪器名称(除铁架台、烧杯、铁架台及附件外)
问题e:加盐酸后,是否需要滤出SiO2后再用NaOH滴定 。
A 需要 B 不需要 C 均可
问题f:碳酸钙纯度计算列式
方案IV(1)称量碳酸钙样品mg(2)加入足量Cmol·L-1HCl
Vml使之完全溶解(3)过滤并取滤液(4)在滤液中加入过量 mol·L-1 Na2CO3溶液V′ml(5)将步骤(4)中沉淀滤出,洗涤干燥,称重m′g
mol·L-1 Na2CO3溶液V′ml(5)将步骤(4)中沉淀滤出,洗涤干燥,称重m′g
 问题g:此方案中不需要的数据是
A CV B
问题g:此方案中不需要的数据是
A CV B 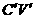 C
C  D m
D m
问题h:为减少误差,步骤(4)反应应
A 精确测定Na2CO3溶液体积V′ml B 精确配制Na2CO3溶液浓度C′mol·L-1
C 将步骤(3)所得沉淀洗涤、洗涤液应一起并入(4)中
D 将步骤(3)所得沉淀洗涤、干燥、称重其质量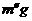 备用,
备用,
综上所述,你认为四个方案中,最好的方案是 。
22.(6分)非整比比合Fe0.95O具有NaCl晶体结构,由于n(Fe):n(O)<1,所以晶体结构存在缺陷。
①Fe0.95O中Fe(II)和Fe(III)各点总铁量的Fe(II) %,Fe(III) %
②写出标明铁价态的化学式
21.(9分)A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为:1∶1和2∶1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y。X分子与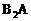 分子中的电子数相同、Y分子中的电子数为18,A,B,D形成离子化合物,其化学式为
分子中的电子数相同、Y分子中的电子数为18,A,B,D形成离子化合物,其化学式为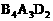 ,其水溶液呈弱酸性;请回答:
,其水溶液呈弱酸性;请回答:
(1)元素符号A 、B 、C 、D 。
(2)写出化学方程式: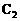 和X(过量)反应
。
和X(过量)反应
。
(3)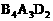 的化学式
,其水溶液呈酸性的离子方程式 。
的化学式
,其水溶液呈酸性的离子方程式 。
(4)液态X能电离(可根据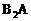 电离推知),其阴离子电子式
。
电离推知),其阴离子电子式
。
20、有Na2CO3、AgNO3、BaCl2、HCl及NH4NO3五瓶无标签溶液,为鉴别它们,取四支试管分别各装入一种溶液,再向上述四支试管中加入少许剩下的一种溶液,下列叙述中错误的是
A 若三支试管出现沉淀时,则后加入的是AgNO3溶液
B 若全部没有明显现象时,则后加入的是NH4NO3溶液
C 若一支试管出现气体,两支试管出现沉淀时,则后加入的是HCl溶液
D 若仅有两支试管出现沉淀时,则后加入的是BaCl2溶液
19、下列说法不正确的是
①往水泥熟料里加石膏,是为了调节水泥的硬化速度 ②医疗上可用碳酸钡作X射线透视肠胃的内服药 ③水玻璃在建筑工业上用作粘合剂 ④炼铜后期向钢水中加入适量的铝或锰铁,是为了除尽钢水中的碳硅等杂质 ⑤氯化铵可用在金属的焊接上,以除去金属表面的氧化物薄层 ⑥“来苏水”是甲醛40%的皂液 ⑦氯化铝、氯化铁、明矾都可用作净水剂
A ②③⑦ B ④⑤⑥ C ①③⑤ D ②④⑥
18、氮气是空气的主要组成部分。因此有科学家根据蒸气机的原理,设计制造出了液氮蒸气机,即利用液态氮的蒸发来驱动机车,从而达到环境保护的目的。其原理的主要依据是
A N2在空气中燃烧放热 B N2与H2反应放热
C N2在空气中约占78%(体积百分数 D 液态氮的沸点为-195.8℃,远低于常温
17、工业上用氨和二氧化碳反应合成尿素: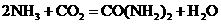 ,已知下列物质在一定条件下均能与水反应产生
,已知下列物质在一定条件下均能与水反应产生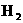 和
和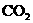 ,
,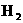 是合成氨的原料,
是合成氨的原料,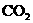 供合成尿素用。若从充分利用原料的角度考虑,为了使
供合成尿素用。若从充分利用原料的角度考虑,为了使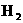 与
与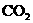 的物质的量之比接近3∶1,最好选用
的物质的量之比接近3∶1,最好选用
(A)石脑油(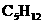 、
、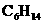 ) (B)
) (B)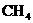 (C)CO (D)碳
(C)CO (D)碳
10、(A)10、30 (B)32 (C)11、30 (D)11、32
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com