
题目列表(包括答案和解析)
7、在标准状况下,碳原子为n和n+1的两种气态烯烃的混合物1L。其质量为2克,则n值为:
A.2 B.3 C.4 D.不能确定
6、常温下一种烷烃A和一种烯烃B组成的混合气体,A和B分子最多只含4个碳原子,且B分子的碳原子数比A分子中多。该1L混合气体充分燃烧生成2.5LCO2,A和B的可能组合及其体积比为:
A.CH4与C3H6,体积比为1∶3 B.CH4与C4H8,体积比为1∶1
C.C2H6与C3H6,体积比为2∶1 D.C2H6与C4H8,体积比为1∶3
5、下列各组有机物不管它们的物质的量以何种比例混合,只要混合物的物质的量一定,则在完全燃烧时,消耗氧气的量恒定不变的是:
A.C3H6 C3H8 B.C4H6 C3H8 C.C5H10 C6H6 D.C3H6 C3H8O
4、a mL三种气态烃与足量的氧气形成的混合物点燃爆炸后,恢复到原来的状态(150℃、1.01×105 Pa)气体体积仍为a mL,则三种烃可能是:
A.CH4、C2H4、C3H4 B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H6 D.C2H4、C2H2、C4H6
3、已知1mol某气态烃CmHn完全燃烧时,需耗氧气5mol 。则m与n 的关系正确的是:
A.m=8-n B.m=10-n C.m=11-n D.m=12-n
2、在20℃时,某气态烃与氧气混合,装入密闭容器中,点燃爆炸后,又恢复到原来状态,此时容器内气体的压强为反应前的一半,经氢氧化钠溶液吸收后,容器内几乎成真空,此烃的分子式可能是:
A.CH4 B.C2H6 C.C3H8 D.C2H4
1、将体积比为1∶1∶2的H2、CO、CH4混合气体VL完全燃烧,所需氧气的体积为:
A.1.25VL B.5VL C.VL D.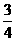 VL
VL
(二)填空题
28.1mol某烃A和1 mol苯完全燃烧,烃A比苯多消耗1mol O2,若A分子结构中无支链或侧链 ,则:
(1)若A为环状化合物,它能与等
物质的量的Br2发生加成反应,则A的结构简式为 ;
(2)若A为链状烯烃,1mol A最多可和2mol Br2发生加成反应且A与等物质的量的Br?2加成 后的可能产物只有2种,则A的结构简式为 。
知识点:本题综合考查了烃的分子组成与结构的关系以及二烯烃发生1,4加成的规律
能力点:培养学生的集中思维能力和创新能力。
29.0.1 mol某烃完全燃烧生成0.4mol H2O,又知其含碳量为92.307%,则此有机物的分子式为 。若它是能聚合成高分子化合物的芳香族化合物,其结构简式为 ;若属饱和烃类,则它的结构简式应为 ,它的一氯代物有 种,二氯代物有 种。
知识点:本题综合考查了烃的分子组成与结构的关系
能力点:培养学生的空间想象能力
30.工程塑料ABS树脂(结构简式如下),合成时用了三种单体,ABS树脂的结构简式:
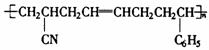 ,这三种单体的结构简式分别是:
.
,这三种单体的结构简式分别是:
.
知识点:本题考查高聚物单体的判断能力点:培养学生的逆向思维能力。
31.在有机反应中,反应物相同而反应条件不同,可得到不同的产物。请看下列反应:
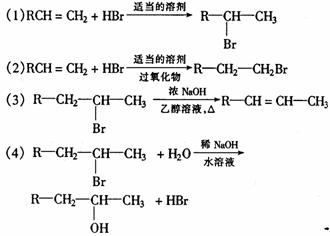
根据以上反应所表现的卤代烃的性质,写出实现下列转变的各步反应的化学方程式,特别注 意反应条件。
(1)由CH3CH2CH2CH2Br分两步转变为CH3-CH2-CHBr-CH3;
(2)由(CH3)2CHCH=CH2分两步转变为(CH3)2CHCH2CH2OH
知识点:本题考查学生对新的信息进行分析并将其转化为一种规律能力点:培养学生将规 律应用在解答问题中的处理能力。
32.已知烯烃、炔烃在臭氧作用下发生以下反应:
CH3-CH=CH-CH2-CH=CH2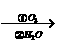 CH3CHO+OHC-CH2-CHO+HCHO
CH3CHO+OHC-CH2-CHO+HCHO
CH3-C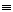 C-CH2-C
C-CH2-C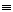 CH
CH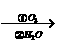 CH3COOH+HOOC-CH2-COOH+HCOOH
CH3COOH+HOOC-CH2-COOH+HCOOH
某烃分子式为C10H10,在臭氧作用下发生反应:
C10H10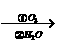 CH3COOH+3HOOC-CHO+CH3CHO
CH3COOH+3HOOC-CHO+CH3CHO
试回答:
(1)C10H10分子中含 个双键、 个叁键。
(2)C10H10的结构简式为 .
知识点:烯烃、炔烃的化学性质
能力点:培养学生对新信息处理、理解、转化的能力。
33.分子式为C6H12的某烯烃的所有碳原子都在同一平面上,则该烯烃的结构简式为 ,名称为 .
本题考查乙烯的分子构型的应用;培养学生的空间想象能力和创新思维能力。
34.直馏汽油的主要成分一般是 ,裂化汽油里还含有 ,如何用化学方法检验一瓶裂化汽油里是否含有甲苯或二甲苯等芳香烃?写出实验步骤。
知识点:本题考查直馏汽油和裂化汽油的区别
能力点:培养学生的理解识记能力和实验分析能力.
35.一定量的C8H18在一定条件下受热完全裂化生成CH4、C2H4、C2H6、C3H6、CH8五种物质的混合物,该混合气体物质的平均式量为 .
知识点:本题考查混合烃的平均式量的计算方法
能力点:培养学生的创新思维能力。
36.碳正离子[例如,CH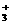 ,C2H
,C2H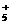 ,(CH3)3C+等]是有机物反应中重要
的中间体。欧拉因在此研究领域中的卓越成就而荣获1994年诺贝尔化学奖,碳正离子CH
,(CH3)3C+等]是有机物反应中重要
的中间体。欧拉因在此研究领域中的卓越成就而荣获1994年诺贝尔化学奖,碳正离子CH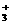 可以通过CH4在“超强酸”中再获得一个H+而得到,而CH
可以通过CH4在“超强酸”中再获得一个H+而得到,而CH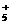 失去H2可得CH
失去H2可得CH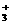 。
。
(1)CH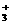 是反应活性很强的正离子,是缺电子的其电子式是
。
是反应活性很强的正离子,是缺电子的其电子式是
。
(2)CH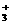 中4个原子是共平面的,三个键角相等,键角应是
(填角度)。
中4个原子是共平面的,三个键角相等,键角应是
(填角度)。
(3)(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式为 。
(4)(CH3)3C+去掉H后将生成电中性的有机分子,其结构简式为 。
知识点:本题考查碳正离子与自由基的区别
能力点:培养学生求同思维能力和处理新信息 的能力。
37.含有C=C-C=C键的化合物与含有C=C双键的化合物很容易发生1,4-环加成反应, 生成六六环化合物,例如:
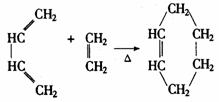
完成下列反应化学方程式(写出适当的反应物或生成物的结构简式)
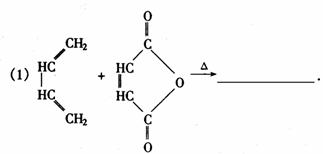
(1)
.
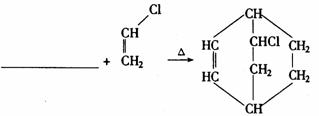 (2)
(2)
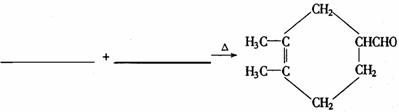
(3)
知识点:本题考查二烯烃1,4加成规律的应用能力点:培养学生处理新信息及将其归纳成 一种规律并加以应用的能力。
38.实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓H2SO4与浓HNO3的混合酸加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50-60℃以下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓H2SO4与浓HNO3混合酸时,操作注意事项是 。
(2)步骤③中,为了使反应在50-60℃下进行,常用的方法是 。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是 。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是 。
(5)纯硝基苯是无色,密度比水 (填“大”或“小”)具有 气味的油状液体。
知识点:本题考查硝基苯的制取原理及其性质能力点:培养学生的实验分析和设计能力。
39.电石中的碳化钙和水能完全反应:CaC2+2H2O C2H2↑+Ca(OH)2使反应产生的气体排水,测量排出水的体积
,可计算出标准状况乙炔的体积,从而可测定电石中CaC2的含量。
C2H2↑+Ca(OH)2使反应产生的气体排水,测量排出水的体积
,可计算出标准状况乙炔的体积,从而可测定电石中CaC2的含量。
(1)若用下列仪器和导管组装实验装置:
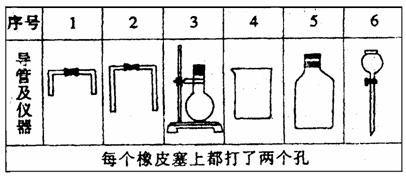 如果所制气流从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是
接
接
接
接
接
接
.
如果所制气流从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是
接
接
接
接
接
接
.
(2)仪器连好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体为止,关闭活塞。
正确的操作顺序是 。
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有 杂质。
(4)若实验时称取的电石为1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为44.8 ml,此电石中CaC2的百分含量是 %。
本题考查乙炔的实验室制法的有关问题和注意事项;培养学生分析问题和处理实验的能力。
40.有一混合气体由一种气态烯烃A和一种气态烷烃B组成,它对H2的相对密度为12,把1体积的混合物和4体积氧气混合,放在密闭容器中,用电火花点燃,使两种烃都充分氧化,如 果反应前后的温度都为150℃,测得容器内压强由反应前的1.00×105Pa增强到反应后的1. 04×105Pa。问烃A、B各是什么烃?它们体积比是多少?
知识点:本题考查平均式量和平均分子式的运用及物质的量与压强的关系
能力点:培养学 生分析问题的综合能力。
41.有两种气态链烃的混合气体,已知它们都能使溴水褪色且分子中碳原子数均小于5;1体 积该混合气体完全燃烧后,可得到3.6体积CO2和3体积水蒸气,气体体积均是在相同温度和压强下测定的:
(1)分析判断两种烃各是哪一类;
(2)通过计算和推理,确立这两种烃的分子式以及它们在混合气体中的体积比。
知识点:烯烃、炔烃(二烯烃)完全燃烧后CO2和H2O的物质的量之间的关系的运用。
能力点:培养学生的创新思维能力和综合思维能力。
(一)选择题
1.下列有关有机物的说法中正确的是( )
A.凡是含碳元素的化合物都属于有机物;
B.易溶于汽油、酒精、苯等有机溶剂中的物质,一定是有机物;
C.所有的有机物都很容易燃烧;
D.大多数有机物聚集时形成分子晶体.
知识点:本题考查有机物的特点
能力点:培养学生的发散思维能力。
2.将4mol 甲烷与氯气发生取代反应,待反应完全后测知四种取代物物质的量相同,测消耗 的氯气有( )
A.2mol B.10mol
C.7.5mol D.6mol
知识点:本题考查烷烃取代反应的特征
能力点:培养学生的发散思维能力。
3.某高分子化合物可以表示为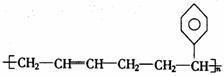 ,则合成该高分子 化合物的单体是( )
,则合成该高分子 化合物的单体是( )
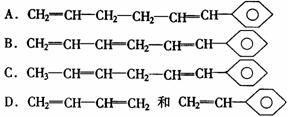
知识点:本题考查高聚物单体的判断及加聚反应的特征
能力点:培养学生的逆向思维能力。
4.与丙烯具有相同的碳、氢百分含量,但既不是同系物又不是同分异构体的是( )
A.环丙烷 B.环丁烷 C.乙烯 D.丙烷
知识点:本题考查同系物和同分异构体的概念
能力点:培养学生的推理能力。
C2H5
|
5.有机物CH3-C=C-CH3的命名正确的是( )
|
C2H5
A.2,3-二乙基-2-丁烯
B.2,3-二乙基-3-丁烯
C.3-甲基-2-乙基-2-戊烯
D.3,4-二甲基-3-己烯
知识点:本题考查烯烃的系统命名法
能力点:培养学生的观察能力。
6.将下列各种液体分别与溴水混合并振荡,静置后混合液分两层,溴水层几乎呈无色( )
A.环己烯 B.碘化钾溶液 C.环己烷 D.酒精
知识点:本题考查有机物的特点及烃的性质
能力点:培养学生综合思考问题的能力。
7.下列物质的沸点由高到低排列的顺序是( )
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH
④(CH3)2CHCH2CH3 ⑤(CH3CH2)2CHCl
A.⑤②④①③ B.④②⑤①③
C.⑤④②①③ D.②④⑤③①
知识点:本题考查烃的同系物及同分异构体沸点高低的有关规律
能力点:培养学生理解识记的能力。
8.120℃时,1体积某烃和4体积O2混合;完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子式中所含的碳原子数不可能是( )
A.1 B.2 C.3 D.4
知识点:本题考查烃燃烧前后物质的量变化规律及各类烃的分子组成特点
能力点:培养学生的创造性思维能力。
9.一种气态烷烃和一种气态烯烃的混合物共10g,平均相对分子质量为25。使混合气通过足 量溴水,溴水增重8.4g,则混合气中的烃可能是( )
A.甲烷和乙烯 B.甲烷和丙烯
C.乙烷和乙烯 D.乙烷和丙烯
知识点:本题考查平均式量的运用和烯烃的性质
能力点:培养学生的综合分析问题的能力。
10.在烧焦的鱼、肉中,含有强烈的致癌物质3,4苯并芘,其结构简式为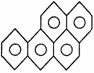 ,它是一种稠环 芳香烃,其分子式为( )
,它是一种稠环 芳香烃,其分子式为( )
A.C20H12 B.C20H34 C.C22H12 D.C30H36
知识点:本题考查碳原子形成四个共价键的特征
能力点:培养学生的观察能力和形象思维能力。
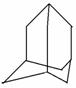 烃A分子的立体结构如右图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名 “金刚烷”,根据题中叙述和图形回答以下11、12两小题。
烃A分子的立体结构如右图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名 “金刚烷”,根据题中叙述和图形回答以下11、12两小题。
11.金刚烷分子中有( )
A.2个-CH3结构
B.4个-CH2-结构
C.4个-CH-结构
|
D.6个-CH-结构
|
知识点:本题考查“碳四价”的运用
能力点:培养学生空间想象能力和形象思维能力。
12.下列不正确的是( )
A.金钢烷分子式是C10H16
B.A分子中有4个6碳环
C.A分子的一氯代物有4种
D.A分子的一氯代物有2种
知识点:考查烃的一元取代物的写法
知识点:培养学生的观察能力和空间想象能力.
13.与H2完全加成后,不可能生成2,2,3-三甲基戊烷的烃是( )
CH3
|
A.CH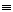 CH-CH-C-CH3 B.C(CH3)3C-C-CH=CH2
CH-CH-C-CH3 B.C(CH3)3C-C-CH=CH2
| | ‖
CH3 CH3 CH2
C.CH2=CHC(CH3)2CH(CH3)2 D.(CH3)3CC(CH3)2=CHCH3
知识点:本题考查烯、炔烯加氢后碳链不变的知识点
能力点:培养学生的集中思维能力.
14.已知分子式为C12H12的物质A结构简式为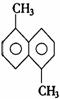 ,A苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的异构体的数目有( )种
,A苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的异构体的数目有( )种
A.9 B.10 C.11 D.12
知识点:本题综合考查有关取代物数目的规律
能力点:培养学生的创新思维能力.
15.某烃的分子式为C10H14,不能使溴水褪色,但可使酸性KMnO4溶液褪色,分子结构中只含一个烷基,则此烷基的结构有( )
A.2种 B.3种 C.4种 D.5种
知识点:本题考查烃的分子组成与结构的关系
能力点:培养学生的发散思维能力。
16.描述CH?3-CH=CH-C≡C-CF3分子结构的下列叙述中,正确的是( )
A.6个碳原子有可能都在一条直线上;
B.6个碳原子不可能在一条直线上;
C.6个碳原子有可能都在同一条平面上;
D.6个碳原子不可能都在同一条平面上.
知识点:本题综合考查了乙烯和乙炔的分子构型
能力点:培养学生的空间想象能力和迁移能力.
17.有关实验室制乙烯的说法中,不正确的是( )
A.温度计要伸入到反应物的液面以下;
B.反应过程中溶液的颜色逐渐变黑;
C.生成的乙烯气体中混有少量有刺激性气味的气体;
D.开始加热时不要太急,使温度逐渐上升至170℃,并保持170℃.
知识点:本题考查实验室制乙烯的相关问题
能力点:培养学生的观察能力和实验能力.
18.等物质的量的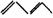 与Br2起加成反应,生成的产物是( )
与Br2起加成反应,生成的产物是( )
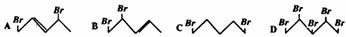
知识点:本题考查二烯烃的加成规律
能力点:培养学生的观察能力和知识迁移能力。
19.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型碳化物,通过对 CaC2制C2H2的反应进行思考,判断下列反应产物正确的是( )
A.ZnC2水解生成C2H6 B.Al4C3水解生成C3H4
C.Mg2C3水解生成C3H4 D.Li2C2水解生成C2H4
知识点:本题考查制乙炔的反应,是个非氧化还原反应
能力点:培养学生的迁移能力。
20.A、B两种烃组成的混合物,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧 消耗氧气的量为一恒量:那么A、B两种烃①互为同分异构体;②互为同系物;③具有相同的 最简式;④含碳的质量分数相同,正确的结论是( )
A.①②③④ B.①③④ C.②③④ D.③④
知识点:本题考查具有相同最简式的有机物燃烧的有关规律
能力点:培养学生的综合思维能力
21.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16mol CO2和3.6g H2O,下列说法正确的是( )
A.混合气体中一定有甲烷;
B.混合气体一定是甲烷和乙烯;
C.混合气体中一定没有乙炔;
D.混合气体中一定有乙炔.
知识点:本题考查烃的平均分子式的确立及运用
能力点:培养学生的推理能力和分析问题的能力.
22.用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为( )
A.3 B.4 C.5 D.6
知识点:本题考查苯环上取代物的书写
能力点:培养学生全面思考问题的能力.
23.当前我国环保急待解决的“白色污染”,通常指的是( )
A.冶炼厂的白色烟尘 B.石灰窑的白色粉末
C.聚乙烯等塑料垃圾 D.白色建筑废料
知识点:本题考查有关环保的问题
能力点:培养学生的环保意识.
24.科学家于1995年合成了一种分子式为C200H200含多个碳碳叁键的链状烃,其分子中含碳碳叁键最多是( )个
A.49 B.50 C.51 D.无法确定
知识点:本题考查烃的分子组成与结构的关系
能力点:培养学生处理新信息的能力.
25.某苯的同系物的分子式为C11H16,经分析分子式中除含苯环外(不含其它环 状结构),还含
|
有两个“-CH3”,两个“-CH2-”、一个“-CH”它的可能结构式有( )
|
A.6种 B.5种 C.4种 D.3种
知识点:本题考查苯的同系物的同分异构体的写法
能力点:培养学生的形象思维能力。
26.燃烧下列混合气体,所产生的CO2的量一定大于燃烧相同质量丙烯所产生的CO2的量的是( )
A.丁烯、丙烷 B.乙炔、乙烯
C.乙炔、丙烷 D.乙烷、环丙烷
知识点:本题考查烃燃烧的有关规律的运用能力点:培养学生分析问题的综合能力。
27.m mol乙炔跟n mol氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡 混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
A.(3m+n)mol
B.(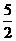 m+
m+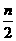 -3p)mol
-3p)mol
C.(3m+n+2p)mol D.( 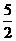 m+
m+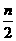 )mol
)mol
能力点:本题考查元素守恒的运用
能力点:培养学生的创造性思维能力。
(二)能力点提示:
1.几种气态烃的实验室制法:
(1)制甲烷
CH3 COONa+NaOH CH4↑+Na2CO3
CH4↑+Na2CO3
要注意断键部位,这也正是要在无水环境中进行的原因;该反应是减少一个碳原子的反应, 如
制乙烷
CH3CH2COONa+NaOH  C2H6↑+Na2CO3
C2H6↑+Na2CO3
制苯
C5H5COONa+NaOH C6H6+Na2CO3
C6H6+Na2CO3
(2)制乙烯
要注意温度控制在170℃左右;该反应是单键变双键的一种反应,如用异丙醇制丙烯:
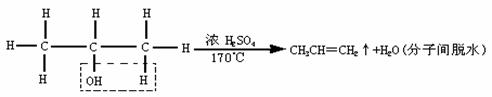
(3)制乙炔
电石与水反应制乙炔时,常伴有特殊难闻的气味,是因为发生以下反应所至:
CaS+2H2O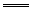 Ca(OH)2+H2S
Ca3P2+6H2O
Ca(OH)2+H2S
Ca3P2+6H2O 3Ca(OH)2+2PH3
3Ca(OH)2+2PH3
Ca3As2+6H2O 3Ca(OH)2+2AsH3↑
3Ca(OH)2+2AsH3↑
2.取代反应的特征
在与卤素单质发生取代反应的过程中,烷烃分子每去掉一个氢原子换上一个卤素原子要消耗1个卤素分子,另外一个卤素原子则与换下来的氢原子结合生成卤化氢(这一点与加成反应是 不同的)。因此烷烃与卤素单质发生取代反应的最大物质的量之比为:CnH2n+2-(2 n+2)X2(卤素单质)
3.加聚反应的书写及高聚物单体的判断
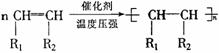 (1)加聚反应的写法:
(1)加聚反应的写法:
① 单烯烃的加聚反应为:
② 共轭二烯烃的加聚反应为:
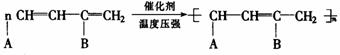
(R1、R2、A、B可以是-H、-CH3、-C2H5或其它基团)
③不同单体加聚时还要考虑可能有不同的连接方式。例如苯乙烯与乙烯间的加聚反应:
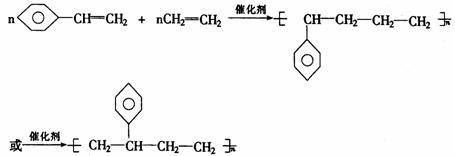
(2)高聚物单体的判断
①聚乙烯型
链节为两个碳原子的,则其单体看作乙烯型,如:
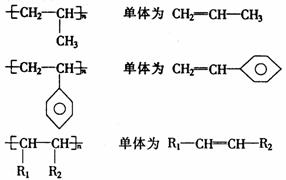
②1,3-丁二烯型
链节为四个碳原子,且2,3碳原子间有C=C,则应对应1,3-丁二烯找单体,如:

③混合型
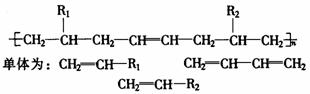
(ⅰ)当链节有四个碳原子,且C、C间无C=C时,应视为含有2个乙烯型单体,如:

(ⅱ)当链节更长时,首先看有无C=C,若有,则与C=C相边的左 右各一个C原子,共同看
作1,3-丁二烯型,其余C原子每两个看作一个乙烯型结构。如:
4.同分异构体的书写
(1) 同分异构体书写通常是按碳链异构 位置异构
位置异构 官能团异构的顺序书写,也可 按官能团异构
官能团异构的顺序书写,也可 按官能团异构 碳链异构
碳链异构 位置异构的顺序书写。例如写出分子式为C4H8的同分异构体时,首先按碳链异构写出:
位置异构的顺序书写。例如写出分子式为C4H8的同分异构体时,首先按碳链异构写出:
① CH2=CH-CH2-CH3 1-丁烯
②CH2=C-CH3 乙-甲基-1-丙烯,再按位置异构写有:
|
CH3
③CH3-CH=CH-CH3 2-丁烯
④CH3-C=CH2 与②式相同排除,最后按官能团异构写有:
|
CH3
 甲基 环丙烷。注意,烷烃没有官能团异构和位置异构,只有碳链异构,因此,碳原子数相同烷烃
和不饱和烃相比,其同分异构体数目要少。
甲基 环丙烷。注意,烷烃没有官能团异构和位置异构,只有碳链异构,因此,碳原子数相同烷烃
和不饱和烃相比,其同分异构体数目要少。
(2)苯环上同分异构体的书写
①苯和甲苯都没有同分异构体,乙苯等其他苯的同系物,由于取代基在苯环上的相对位置不 同因此存在同分异构体。
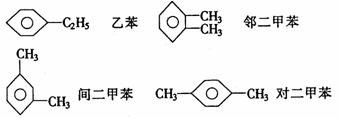
分子式为C8H10的同分异构体有四种:
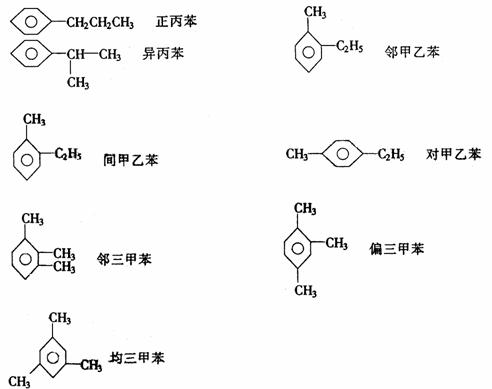
分子式为C9H12的同分异构体有8种:
 E
E
②苯的同系物被一个原子团取代,如:
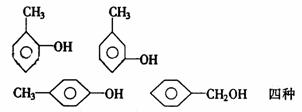
二甲苯的取代
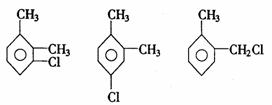
邻二甲苯的一氯代物:
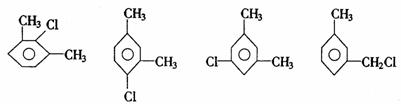
间二甲苯的一氯代物:
对二甲苯的一氯代物:
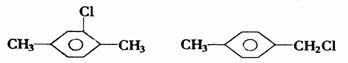
判断因取代基位置不同而形成的同分异构体时可采用“对称轴”法。即在被取代的主体结构 中,划对称轴,取代茎只能在对称轴的一侧,或是在对称轴上而不能越过对称轴(针对一元取代物而言)。如二甲苯的对称轴如下(虚线表示):
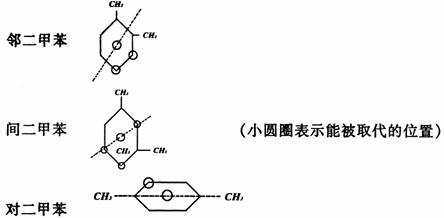
因此,邻、间、对二甲苯苯环上的一元取代物分别有2、3、1种。
5.计算并推断烃的分子式及其结构简式
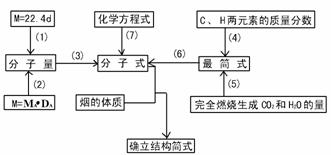
注:
(1)气体摩尔质量=22.4L/mol ×dg/L(d为标准状况下气体密度).
(2)某气体对A气体的相对密度为DA,则该气体式量M=MADA.
(3)由烃的分子量求分子式的方法:
①M/14,能除尽,可推知为烯烃或环烷烃,其商为碳原子数;
②M/14,余2能除尽,可推知为烷烃,其商为碳原子数;
③M/14,差2能除尽,推知为炔烃或二烯烃或环烯烃,其商为碳原子数。
④M/14,差6能除尽,推知为苯或苯的同系物。
6.烃完全燃烧的有关规律
(1)等物质的量的烃(CnHm)完全燃烧时,耗氧量的多少决定于n+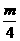 的值,n+
的值,n+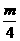 的值越大,耗氧量越多,反之越少。
的值越大,耗氧量越多,反之越少。
(2)等质量的烃(CnHm)完全燃烧时,耗氧量的多少决定于氢的质量分数,即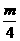 的值,
的值,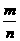 越大,耗氧量越多,反之越少。
越大,耗氧量越多,反之越少。
(3)等质量的烃(CnHm)完全燃烧时,碳的质量分数越大,生成的CO2越多,氢的质量分数越大,生成的H2O越多。
(4)最简式相同的烃无论以何种比例混合,都有:①混合物中碳氢元素的质量比及质量分数 不变;②一定质量的混合烃完全燃烧时消耗O2的质量不变,生成的CO2的质量均不变。
(5)对于分子式为CnHm的烃:
①当m=4时,完全燃烧前后物质的量不变;
②当m<4时,完全燃烧后物质的量减少;
③当m>4时,完全燃烧后物质的量增加.
7.各类烃与H?2加成的物质的量之比:
|
不饱和烃 |
与H2加成的最大物质的量之比 |
|
烯烃 |
1∶1 |
|
二烯烃 |
1∶2 |
|
炔烃 |
1∶2 |
|
苯及其同系物 |
1∶3 |
苯乙烯 |
1∶4 |
8.二烯烃1,4加成的规律:
只有具备R′-CH=CH-CH=CH-R结构特点的二烯烃才能进行1,4加成,其与卤素单质的加成产物为 :
R′-CH=CH-CH=CH-R
| |
X X
若二烯烃的结构为R-CH=CH-CH2-CH=CH-R′,则不能进行1,4加成,只能进行1,2加成.
9.根据烃的分子式推断其可能具有的结构
从烷烃通式CnH2n+2?出发,分子中每形成一个C=C键或形成一个环,则减少2个氢原子;分子中每形成一个C≡C键,则减少4个氢原子。依此规律可由烃的分子式推测其可能具有的结构,再由其性质可确定其结构简式。例如分子式为C5H8的烃可与等物质的量Br2加成,试推测其可能的结构并写出其结构简式.先根据其分子组成可知其分子比对应的C5 H12少4个氢原子,可能是二烯烃、炔烃或环烯烃,再根据其与Br2的加成比例可知
其为环烯烃,结构简式为 或
或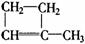 等。
等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com