
题目列表(包括答案和解析)
21.(本小题共11分) (1)已知4℃时四种化合物在水中和液氨中的溶解度如下表:
|
|
AgNO3 |
Ba (NO3)2 |
AgCl |
BaCl2 |
|
H2O(l) |
170g |
9.20g |
1.50×10-4g |
33.3g |
|
NH3(l) |
86.0g |
97.2g |
0.80g |
0.00g |
①上述四种物质能在水中发生的复分解反应为_________________________________;
② 能在液氨中发生的复分解反应为__________________________________________。
(2)在热的稀硫酸溶液中溶解11.4gFeSO4,当加入50mL0.5molKNO3溶液后,使其中 Fe2+全部转化成为Fe3+,KNO3也反应完全,并有 NxOy气体逸出,配平如下化学方程式:
□ FeSO4+□KNO3+□ H2SO4= □ K2SO4+□ Fe2(SO4)3+□ NxOv+□ H2O
①推算出x=________;y=__________;反应中的氧化剂_________。
②如果将产生的NxOy,气体与CO2混合通过过氧化钠固体,体积减少为原混合气体的1/2,则原混合气体中C O2物质的量(n)的取值为_____________mol。
20. (本小题共10分) 已知:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,计算下列中和反应中放出的热量。
①用 20gNaOH配成稀溶液跟足量的稀盐酸反应,能放出_____________ kJ的热量。
②用0.lmolBa(OH)2配成稀溶液踢足量的稀硝酸反应,能放出_____________kJ的热量。
③用 l.00L1.00mol/L醋酸溶液与2.00L1.00mol/L NaOH溶液反应,放出的热量________
(填“大于”、“小于”或“等于”)57.3kJ,理由是______________________________
____________________________________________________________________________
19.(本小题共9分)亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是 Na2SO3+ KIO3+ H2SO4→Na2SO4+ K2SO4+ I2+ H2O(未配平):
(l)其中氧化剂是_________,若反应中有5mol电子转移,则生成的碘是__________ mol。
(2)该反应过程和机理较复杂,一般认为分以下几步:
①IO3一+SO32一→IO2一+SO42一(反应慢)
②IO2一+ 2 SO32一→I一+SO42一(反应快)
③5I一+ 6H++IO3一 →3I2+ 3H2O反应快)
④I2十SO32一十 H2O→2I一十SO42一十2H+(反应快)
根据上述条件推测,此反应速率由_____________步反应决定(填序号)。
(3)若预先加入淀粉溶液,由反应过程看,必在_______离子消耗完时,才会有使淀粉变蓝的现象产生。原因是_____________________ ____。
18. W g胆矾晶体溶解在V L水中,在等温下配成密度为d g/cm3、质量分数为A%、物质的量浓度为 c mol/L、溶质的溶解度为 s g的饱和溶液,则下列表示式正确的是 ( )
A.A=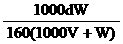 B.A%=
B.A%=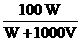
C.s=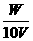 D.c=
D.c=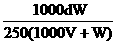
第II卷 (非选择题满分78分)
17.硒(Se)是半导体材料,也是补硒保健品中的元素。工业上提取硒的方法之一是用H2SO4和NaNO3处理含Se的工业废料,而得到亚硒酸(H2SeO3)和少量硒酸(H2SeO4),浓缩后再将它们与盐酸共热,使H2SeO4转化为H2SeO3,其主要反应为:2HCl+H2SeO4=H2SeO3+H2O+Cl2↑, 然后向溶液中通入SO2使硒元素还原为单质硒沉淀,下列判断正确的是
( )
A.H2SeO4氧化性比 Cl2弱 B.H2SO4的氧化性比H2SeO3弱
C.H2SO3的还原性比H2SeO3强 D.H2SeO3的还原性比HCl强
16.硫代硫酸钠可作为脱氧剂,已知25.0mL 0.0100mol/LNa2S2O3溶液恰好把22.4mL(标准状况下)Cl2完全转化为Cl一离子,则S2O32-将转化成 ( )
A.S2- B.S C.SO32- D.SO42-
15.实现下列变化既不需要另加入还原剂,也不需要另加入氧化剂的是 ( )
A.C12→ClO- B.HNO3→NO
C.Mg→Mg2+ D.Na2 O2→O2
14.在一定条件下发生如下反应:RO3n-+2R2-+6H+= 3R+3H2O,下列关于 R的叙述中正确的是 ( )
A.R原子是外层上有4个电子
B.RO3n-中的R只能被还原
C.HnRO3是强酸
D.R的单质既有氧化性又有还原性
13.下列离子方程式正确的是 ( )
A. 向 Ba(OH)2溶液中逐滴加入 NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+ NH4+十 H++SO42-=Ba SO4↓+ NH3· H2O+ H2O
B.用Pt电极电解 MgCl2溶液: 电解
2Cl-+ 2H2O = 2OH-十H2↑十 Cl2↑
C.碳酸氢钠溶液与硫酸氢钠溶液反应:
HCO3-+H+=CO2↑十H2O
D.向漂白粉溶液中通入SO2 :
Ca2++2ClO-+SO2十H2O =Ca SO4↓十 2HClO
12.已知某温度下的热化学方程式:2SO2(气)+O2(气)=2SO3(气);△H= -197kJ/mol
在同温同压下向密闭容器中通入2 mol SO2和1 molO2,达平衡时放出热量Q1 kJ;向另一相同的密闭容器中通入1.5 mol SO2 、0.75 molO2 和0.5mol SO3 ,达平衡时放出热量Q2 kJ,下列关系正确的是 ( )
A.Q1< Q2< 197 B.Ql= Q2< 197
C.Q1> Q2> 197 D.Q2< Q1< 197
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com