
题目列表(包括答案和解析)
1.在上述臭氧变成氧气的反应过程中,Cl是( ). (A)反应物 (B)生成物 (C)中间产物 (D)催化剂 2.O3和O2是( ). (A)同分异构体 (B)同系物 (C)氧的同素异形体 (D)氧的同位素
1. 1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家.大气中的臭氧层可滤除大量的紫外光,保护地球上的生物.氟利昂(如CCl2F2可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3).有关反应为:
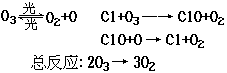
6.若已发现了116号元素R,则下列叙述中正确的是
①其钠盐的分子式为Na2R ②其最高价氧化物的水化物是强酸 ③R是金属元素 ④R是非金属元素 ⑤其最高价氧化物的分子式为RO3
A.①③⑤ B.②④ C.③⑤ D.②③⑤
[基础知识点2]臭氧(O3)和双氧水(H2O2)
5.微量硒(Se)元素对人体有保健作用,我国含有丰富的硒矿资源.已知硒与氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是
A.单质硒既能溶于盐酸又能溶于烧碱溶液产生氢气
B.硒的最高价氧化物的化学式为SeO3
C.硒的非金属性比溴弱,比砷强
D.硒的气态氢化物的化学式为H2Se.H2Se不稳定
4.钋是原子序数最大的氧族元素,推测钋及钋的化合物最不可能存在的性质是
A.钋是能导电的固体 B.钋与氢气不可能直接化合
C.钋的氧化物和水化物至少有两种 D.钋的氢化物很稳定
3.按核电荷数的增加,氧族元素的下列性质按递增顺序排列的是
①单质的熔点,②元素的非金属性,③氢化物的还原性,④与H2反应的能力,⑤+6价氧化物对应水货物 的酸性,⑥阴离子的半径.
A.①②③ B.④⑤⑥ C.③④⑤ D.①③⑥
2.下列能说明元素R一定为氧族元素的是
A.R为非金属元素,其氧化物对应水化物是强酸
B.R原子的最外层电子层上有6个电子
C.R的单质与H2化合生成H2R
D.R氢化物的水溶液呈酸性
[基础知识点1]氧族元素的原子结构及其单质和化合物性质递变
1.关于氧族元素的叙述错误的是
A.随着核电荷数的增加,氧、硫、硒、碲元素的金属性逐渐增强
B.H2SO4的酸性比H2TeO4强
C.H2S的还原性比H2Se弱
D.在OF2化合物中氟元素是+1价,氧元素是-2价
26.(12分)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气) C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
25.(8分)取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol·L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol·L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00ml·L-1盐酸恰好完全中和。计算混合物中各物质的质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com