
题目列表(包括答案和解析)
7.家用消毒液发生器是化学知识在日常生活中的“创新”应用,该发生器利用常见的精盐和自来水为反应物。通电时,器内电解槽的极板上产生大量气泡,切断电源后所得消毒液具有强烈的杀菌能力,且对人体无害。与该反应器直接有关的反应是( )

①2NaCl + 2H2O 2NaOH +H2 ↑+Cl2↑
②H2 +Cl2 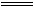 2HCl
2HCl
③Cl2+2NaOH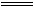 NaCl + NaClO +H2O
NaCl + NaClO +H2O
④NaClO + HCl 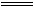 NaCl +HClO
NaCl +HClO
A.只有① B.①③ C.①③④ D.①②③④
6.用铂电极电解CuSO4溶液,当c(Cu2+)降至原来的一半时停止通电,则加入下面物质能使溶液恢复成原来浓度的是( )
A.无水CuSO4 B.CuO C.Cu(OH)2 D.CuSO4·5H2O
5.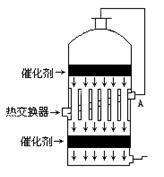 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)按此密闭体系中气体的流向,则在A处流出的气体为 ( )
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)按此密闭体系中气体的流向,则在A处流出的气体为 ( )
A.SO2 ,N2
B.SO3,O2,N2
C.SO2,O2,N2
D.SO2,SO3,N2
4.已知在25℃,101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40kJ热量。表示上述反应的热化学方程式正确的是 ( )
A. C8H18(l)+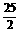 O2(g)
O2(g)  8CO2(g)+
9H2O(g);△H=-48.40kJ/mol
8CO2(g)+
9H2O(g);△H=-48.40kJ/mol
B. C8H18(l)+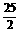 O2(g)
O2(g)  8CO2(g)+
9H2O(l);△H=-5518kJ/mol
8CO2(g)+
9H2O(l);△H=-5518kJ/mol
C. C8H18(l)+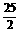 O2(g)
O2(g)  8CO2(g)+
9H2O(l);△H= + 5518kJ/mol
8CO2(g)+
9H2O(l);△H= + 5518kJ/mol
D. C8H18(l)+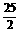 O2(g)
O2(g)  8CO2(g)+
9H2O(l);△H=-48.40kJ/mol
8CO2(g)+
9H2O(l);△H=-48.40kJ/mol
3.实现下列变化时,需克服相同类型作用力的是 ( )
A.水晶和干冰的熔化 B.食盐和冰醋酸熔化
C.液溴和液汞的气化 D.纯碱和烧碱的熔化
2.下列反应既属于氧化还原反应,又是吸热反应的是 ( )
A.Al与稀盐酸反应 B.灼热的碳与CO2反应
C.CH4在空气中燃烧 D.Ba(OH)2—8H2O与NH4Cl 反应
1.下列有关分散系属于胶体的是 ( )
A.食盐水 B.碘酒 C.植物油 D.淀粉溶液
|
次序 |
稀盐酸(mL) |
余固体(g) |
|
1 |
先加入5.0mL |
1.32 |
|
2 |
再加入5.0mL |
0.64 |
|
3 |
再加入5.0mL |
0.20 |
|
4 |
再加入5.0mL |
0.20 |
26(7分)实验室有一种含有少量二氧化硅杂质的石灰石样品,某同学想准确测定该样品的纯度,他取用2.0g样品于烧杯中,把20.0mL稀盐酸分4次加入,充分作用后记录烧杯中固体质量表。请选择合适的数据并计算:
(1)该样品的纯度是多少?
(2)所取用的稀盐酸的物质的量浓度?
27.(10分)有一瓶(约100mL)硫酸和硝酸的混合溶液,量取10.00mL该混合溶液,加入足量的氯化钡溶液,充分反应后过滤、洗涤、烘干(忽略过程中的损失),可得到2.33g沉淀。将滤液用2.00ml L-1的NaOH溶液滴定,消耗35.00mL时达到滴定终点。请完成下列问题:
(1)写出上述实验过程中所有反应的化学方程式:
(2)通过计算确定原混合溶液中H2SO4和HNO3的物质的量浓度;
(3)另取10.00mL原混合酸溶液,加入1.60g铜粉充分作用后,无沉淀且溶液pH=2,计算在标况下生成的气体体积(不考虑气体的溶解和N2O4,溶液体积变化忽略不计)。
24、(11分)在一定条件下可实现下列物质间的转化,如下图所示:

①
②
(1) 固体A是一种可由石灰石来制取的重要工业原料,其化学式为: 。
(2) 写出反应①和②化学方程式:
①
②
(3) 上述变化中生成的C和过量的丙恰好能完全反应。该反应的化学方程式为
23.(10分)某温度(t℃)时,水的KW=10-13,则该温度应 (填写>、<或=)25℃,理由是 。将该温度下pH=11的aL NaOH溶液与pH=1的bL H2SO4溶液充分混合(忽略溶液体积变化),则有:
(1)若所得混合溶液为中性,则a:b ;
(2)若所得混合溶液的pH=2,则a:b 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com