
题目列表(包括答案和解析)
20.(8分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为气体化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。
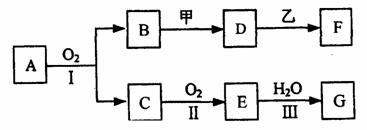
则①A的分子式是 ,甲的电子式是 。
(2)D的溶液与乙反应的离子方程式是 。
(3)若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式: 。
19.(10分)根据表中左栏信息,回答右栏有关问题:
|
信 息 |
问 题 |
|
①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数。其中X是形成化合物种类最多的元素。 |
(10)X元素的最高价氧化物的电子式是 _______ |
|
②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液。 |
(2)Z元素在元素周期表中位于第_____ 周期,_____族。 |
|
③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成。 |
(3)写出生成白色沉淀的化学方程式_____
__。 |
|
④向上述四种元素的单质的混合物中加入足量的烧碱,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中有白色沉淀。 |
⑷最终生成白色沉淀的离子方程式为_____
__。 |
|
⑸X、Y、Z、W四种元素的原子半径由大到小的顺序为____________(用元素符号表示) |
第Ⅱ卷 (非选择题 共56分)
18. 制备氰氨基化钙的化学方程式为CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,在反应中( )
A.氢元素被氧化,碳元素被还原 B.HCN既是氧化剂又是还原剂
C.CaCN2是还原产物,H2为氧化产物 D.CO是氧化产物,H2为还原产物
17. 利尿剂是2008北京奥运会违禁药物,顾名思义,此类药物有稀释尿液的功能。利尿剂现有15种,主要用于掩盖或“清洗”体内其它违禁药品的存在,以逃避兴奋剂检查。利尿酸是其中之一,其结构简式为:
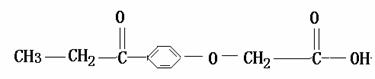
下列叙述正确的是( )
A.1mol利尿酸最多可与5mol H2发生加成反应
B.利尿酸分子中位于同一平面内的原子有10个
C.利尿酸分子式是C11H12O4
D.利尿酸与新制Cu(OH)2悬浊液反应有红色沉淀生成
16.铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4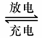 2PbSO4+2H2O(如图),则下列说法正确的是( )
2PbSO4+2H2O(如图),则下列说法正确的是( )
A.放电时负极反应是:Pb-2e-=Pb2+,充电是阴极反应是:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.闭合K断开K1,电流的流动方向是从B到A
C.放电过程中,溶液的pH不断减小
D.放电时,线路上若有1mole-通过,则消耗硫酸也是1mol
15. 现有t℃时质量分数为a %的KNO3溶液m g,将其分成质量比为1∶2的甲、乙两份溶液。甲溶液蒸发5 g水,恢复到原温度时析出晶体2 g;乙溶液蒸发12 g水,恢复到原温度时析出晶体5 g。则t℃时,KNO3溶解度为 ( )
A.41.7 g B.50 g C.43 g D.60 g
14.下列指定条件下的结果正确的是( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10mL 0.02mol·L-1 HCl溶液与10mL 0.02mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol·L-1 CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
13.“类推”是一种常用的学习方法,但有时类推会产生错误的结论,下列类推结论中正确的是( )
A.NH4Cl加热分解只生成HCl和NH3,NH4I固体加热分解也只生成HI和NH3
B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
C.溶液中有阳离子,必有阴离子,则晶体中有阳离子,必有阴离子
D.干冰(CO2)是分子晶体,则SiO2也是分子晶体
12.T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
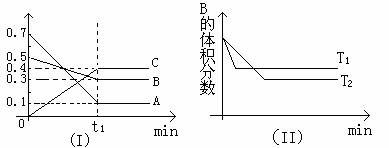
A.在t1时间内用B表示该反应的平均速率为:0.6mol·L-1·mim-1
B.在(t1+10)时,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.T时,在相同容器中,若由0.3mol·L-1A、0.1mol·L-1B和0.4mol·L-1C反应,达到平衡后,C的浓度仍为0.4mol·L-1
D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com