
题目列表(包括答案和解析)
6.下列说法正确的是 ( )
A.离子化合物中一定含有金属元素
B.构成分子晶体的微粒中一定含有共价键
C.原子晶体熔化要破坏共价键
D.只有离子化合物中才存在离子
5.已知反应: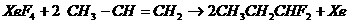 ,下列有关说法正确的是 ( )
,下列有关说法正确的是 ( )
A.该反应不属于氧化还原反应
B.XeF4既是氧化剂,又是还原剂
C.反应中电子由Xe转移到C
D.氧化剂与还原剂的物质的量之比为1:2
4.已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是 ( )
A.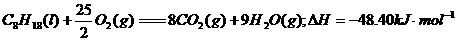
B.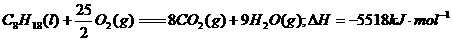
C.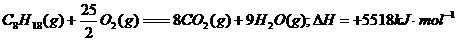
D.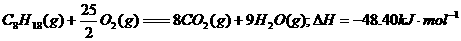
2.13C-NMR(核磁共振)15N-NMR可用于测定蛋白质核酸等生物大分子的空间结构,Kurt Wuthrich等人为此获得2002年诺贝尔化学奖。下列有关13C、15N叙述正确的是( )
A.13C与15N有相同的中子数 B.13C与C60有相同的中子数
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
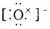 3.下列电子式中错误的是 ( )
3.下列电子式中错误的是 ( )
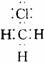
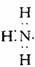 A.Na+ B.
A.Na+ B.
C. D.
1.设NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.1.8g铵离子所含的电子数为1.1NA
B.1mol白磷分子中所含共价键数为4NA
C.标况下22.4L乙醇所含的分子数必定为NA
D.在电解食盐水的实验中,测得电解后溶液的pH为14,又知电解后溶液总体积为1L,则阴极析出的气体的分子数为0.5NA
24、(9`)在标准状况下,将224 L HCl气体溶于635 mL水中(ρ=1 g/cm3),所得盐酸的密度为1.18 g/cm3。试计算:
(1) 取出这种盐酸100.0 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度。
(2)在40.0 mL 0.0650 mol·L-1Na2CO3溶液中,逐滴加入(1)所配制的稀盐酸,边滴边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不能超过多少毫升?
答案 1、C 2、C 3、A 4、D 5、C 6、D 7、B 8、A 9、BC 10、AC、 11、BC、12、BD 13、B 14、C 15、D 16、A 17、B 18、BD 19、(1) 1、2、4、3、5 (3)偏高、 (4)偏低、偏低、 (5)重做、重做 20、(1)Zn,将Cu2+、Fe3+还原 (2)20%的H2O2, 将Fe2+氧化为Fe3+,同时不引入杂质离子 (3)ZnO或ZnCO3或Zn(OH)2,调节溶液的PH值将Fe3+沉淀 21、(1)O、H、N、Cl 22、(1)0.93-1.57 (2)2.25-3.44 (2)X越大,原子半径越小, 周期性 (3)氮 (4)共价键 (5)六-IA 23、3:2 24、1mol/L 2.6mL
23、(8`)已知下列两个热化学方程式;
H2(g)+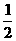 O2(g)==== H2O(l );△H= -285.8kJ/ mol
O2(g)==== H2O(l );△H= -285.8kJ/ mol
C3H8(g)+5O2(g) ==== 3CO2(g) +4H2O(l);△H= -2220.0 kJ/ mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热5297.4kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(l)=H2O(g);△H=+44.0 kJ/ mol
试写出丙烷燃烧生成CO2和水蒸气热化学方程式。
20、(15`)某小型化工厂生产皓矾(ZnSO4·7H2O)的工艺流程如下图所示:
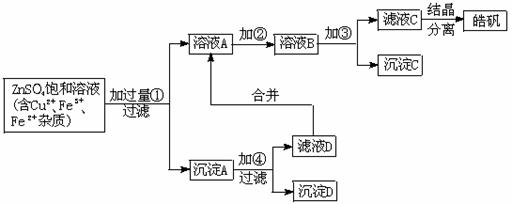
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0
试回答下列有关问题:
(1)加入的试剂①应是 ,
其目的是 。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
(3)加入的试剂③是
的目的是 。
21(14`)、A、B、C、D均为短周期元素,A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2:A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈弱酸性:B与D可形成一种极易溶于水的碱性气体X,B与C可能形成极易溶于水的酸性气体Y,已知X分子与B2A分子中的电子数相等,Y分子中的电子数与最简式为BA的电子相等,请回答:
(1)写出四种元素的符号:A________ B________ C________ D________
(2)写出下列反应的化学方程式:
①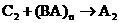 :________________________________
:________________________________
②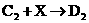 :________________________________
:________________________________
(3)B4A3D2的化学式为___________,其水溶液显酸性的离子方程式为_________________________________。
(4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为__________________________。
22(14`)、不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成分为带负电荷的一方。
下面是某些短周期元素的x值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.25 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1) 通过分析x值变化规律,确定Mg、N的x值范围:
<x(Mg)< , <x(N)< 。
(2)推测x值与原子半径的关系是 。据据短周期元素的x值变化特点,体现了元素性质的 变化规律。
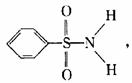
(3)某有机化合物结构式为: 其中S-N键中你认
为共用电子对偏向谁? (写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx<1.7,一般为共价键,试推断:AlBr3中化学键类型是 。
(5)预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
19、(16`)实验室配制500 mL 0.5 mol·L-1的NaC1溶液,有如下操作步骤:
①把称量好的NaC1晶体放入小烧怀中,加适量蒸馏水溶解;②把①所得溶液小心转入500 mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距刻度1 cm - 2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞塞紧,充分摇匀。填写下列空白:
(1)操作步骤的正确顺序为_______ _ (填序号)。
(2)本实验用到的基本实验仪器有 。
(3)某同学俯视容量瓶刻度线滴加蒸馏水而定容,对所配溶液浓度有何影响?________(“偏高”“偏低”或“无影响”)。
(4)若出现如下情况,对所配溶液浓度将有何影响:
没有进行操作步骤④________;加蒸馏水时不慎超过了刻度________。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度 。
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面
18、下列画有横线的物质在反应中不能完全消耗的是
A.将含少量H2O(g)的H2通入盛有足量Na2O2的容器中并不断用电火花点燃
B.将l mol Cu置于含2 mo1H2SO4的浓硫酸中加热
C.在强光持续照射下,向过量的Ca(C1O)2溶液中通入少量的CO2
D.在一定条件下,3体积H2和1体积N2在催化剂存在下反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com