
题目列表(包括答案和解析)
7.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是 ( )
A.硫酸铜的溶解度 B.溶液中溶质的质量分数
C.溶液的质量
D.溶液中Cu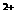 的数目
的数目
6.X是由两种短周期元素构成的离子化合物,1 mol X含有20 mol电子。下列说法中不正确的是
A.晶体中阳离子和阴离子所含电子数一定相等
B.晶体中一定只有离子键没有共价键
C.所含元素一定不在同一周期也不在第一周期
D.晶体中阳离子半径一定小于阴离子半径
5.从下列事实所列出的相应结论正确的是
|
|
实 验 事 实 |
结 论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
4.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色处理剂。工业上先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O
干法制备的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是
A.高铁酸钾中铁显+6价
B.湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
3.下列离子方程式正确的是 ( )
A.澄清石灰水中滴加稀硝酸:Ca(OH)2+2H+ = Ca2++2H2O
B.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.在标准状况下,向10mL 0.1moL/LFeBr2溶液中通入22.4mL氯气:2Fe2++2Br-+2C12 ==2Fe3++ Br2+ 4C1-
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
OH-+Ca2++HCO3- ===CaCO3↓+H2O
2.NA为阿伏加德罗常数,下列正确的是
A.80g硝铵含有氮原子数为2NA
B.1L1mol·L-1的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2L四氯化碳所含分子数为0.5NA
D.在铁与氯气的反应中,1mol铁失去的电子数为2NA
1.仅能在水溶液中导电的物质是
A.NaNO2 B.甘油 C.KOH D.NaHCO3
25.(10分)铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入100mL 0.6mol/LHNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学反应方程式_______________________________;
(2)产物中硝酸铜的物质的量______________mol;
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol;
(4)如混合物中Cu的物质的量为X,求X的取值范围________________。
24.(8分)碘盐是日常生活中必不可少的调味品,我国强制推广食用加碘盐。根据GB5461--《国家食用盐标准》,碘元素含量为20-50mg/kg为合格。质量监督部门为检测某品牌加碘盐是否合格,进行了如下实验:称取250g 某品牌加碘盐样品,在酸性条件下用足量KI溶液将其中IO3-全部转化成I2,生成的I2再用0.010mol/L的硫代硫酸钠溶液滴定,滴定到终点时用去12mL。
有关反应如下:
①IO3-+5I-+6 H+ 3I2+3H2O
3I2+3H2O
②I2+2S2O32- 2I-+S4O62-
2I-+S4O62-
(1)用硫代硫酸钠溶液滴定I2时,应用_________作指示剂,滴定到终点的现象是________;
(2)试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程)。
23.(10分)塑料是日常生活中常用的合成高分子材料,常用塑料F、G均可由某烃经下列反应得到:
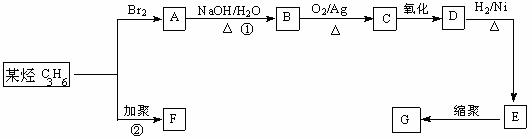
(1)写出高分子化合物G的结构简式:_____________________;
(2)写出反应①的化学方程式:_________________________________________;
(3)写出反应②化学方程式:_____________________________________________;
(4)PBT(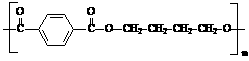 )是一种最重要的工程塑料之一。
)是一种最重要的工程塑料之一。
已知:①、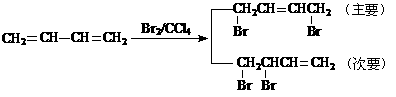
②、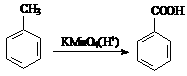
请设计方案以CH2=CHCH=CH2、 为原料合成PBT;请用反应流程图表示,并注明反应条件。
为原料合成PBT;请用反应流程图表示,并注明反应条件。
示例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH CH2=CH2
CH2=CH2
 CH2-CH2
CH2-CH2
合成PBT的反应流程图为__________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com