
题目列表(包括答案和解析)
30. (9分)有混合气体X,它是由NO、H2、CO2组成,通入足量的Na2O2后,变成混合气体Y,将Y用电火花引燃使其充分反应,只得到浓度为70%的HNO3溶液,无其他任何气体,求X中各气体体积之比。
 31 (12分)如图所示装置中,容器甲内充入0.1 mol NO气体,
31 (12分)如图所示装置中,容器甲内充入0.1 mol NO气体,
干燥管内装有一定量Na2O2,从A处缓慢通入CO2
气体,恒温下,容器甲中活塞缓慢由B向左移动,
当移至C处时,体积缩小至最小,为原体积的9/10。随着CO2的继续通入,活塞又逐渐向右移动。
(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g,此时,通入标准状况下的CO2气体多少L?容器甲中NO2转化为N2O4的转化率是多少?
②活塞移至C处后,继续通入amolCO2,此时活塞恰好回至B处。则a值必小于0.01,其理由是 .
(2)若改变干燥管中的Na2O2质量,可通过调节甲容器的温度及通入CO2的量,使活塞发生从B到C,又从C到B的移动,则Na2O2的质量最小值应大于 g。
29. (8分)在一包白色粉末,它是由KCL、(NH4)2CO3 、(NH4)2SO4、Ca(NO3)2和BaCl2五种化合物中的两种混合而成,今按下列步骤进行实验;
(1) 白色粉末和熟石灰一起研磨,可产生有刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝。
(2) 另取少量粉末加足量的蒸馏水搅拌,有白色沉淀产生,该沉淀不溶于稀HNO3。
(3) 取第二步的滤液中加入AgNO 3溶液骨不溶于稀HNO3的白色沉淀生成。
则这包白色粉末是由 和 混合而成,写出有关的化学(或离子)方程式:
第(1)步
第(2)步
第(3)步
28. (12分) 用示意图中的简易装置可以进行气体的发生和收集。
(1)实验前应如何检查该装置的气密性 。
(2)拔开试管a的橡皮塞,加入10 mL6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速度缓慢,然后逐渐加快。请写出试管a中发生的所有反应的化学方程式 。
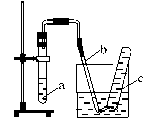 (3)从反应开始到反应结束,在试管a中可观察到哪些现象?
(3)从反应开始到反应结束,在试管a中可观察到哪些现象?
请依次逐一写出
。
(4)在反应开始时,可观察到导管b中的水面先沿导管b慢
慢上升到一定高度,此后又回落,然后有气泡从管口冒出。
试说明反应开始时,导管中水面先上升的原因
。
(5)试管c收集满气体后,用拇指堵住管口,取出水槽。将管口向上,松开拇指,片刻后,再次堵住管口,将试管又再倒置于水槽中,松开拇指。此时可观察到什么现象?
。
实验题实验
27. (10分) 用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
已知:①NO+NO2+2OH-=2NO2-+H2O②气体液化温度:NO2为0.21℃,NO为-152℃
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为 。
(2)反应前先通入N2目的是 。
(3)确认气体中含NO的现象是 。
(4)装置F的作用是 。
(5)如果O2过量,则装置B中发生反应的化学方程式为: 。

26. (16分)常温下,有一无色混合气体,可能由Cl2、HCl、NO、O2、CO2、N2、H2、NH3中的两种或多种组成,取此混合气体200mL进行实验如下:
(1)将此气体通过浓硫酸体积减少40mL;
(2)剩余气体通过足量过氧化钠固体,体积又减少40mL;
(3)剩余气体仍为无色,引燃后冷却至常温,体积又减少105mL;
(4)最后剩余气体为15mL,经分析知道其中氧气占1/3。则原混合气体中一定不含 ,一定含 ,其体积分别是 。
25. (10分) NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点。NO亦被称为“明星分子”,试回答下列问题:
(1)NO对环境的危害在于 (填以下项目的编号)。
A. 破坏臭氧层
B. 高温下能使一些金属被氧化
C. 造成酸雨
D. 与人体血红蛋白结合
(2)在含Cu+离子酶活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝根离子在酸性水溶液中反应的离子方程式 。
(3)在常温下,将NO气体压缩到1.01×107Pa,在一个体积固定的容器里加热到50℃。发现气体的压强迅速下降,压强降至略小于原压强2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式。
___________________________________________________________________
(4)解释(3)中为什么最后的气体总压强小于原压强的2/3?
______________________________________________________________________。
24.(10分) 砷的原子序数为33,在元素周期表里,砷元素位于 周期 族,它的最高价氧化物的化学式为 ,砷酸钠的化学式为 ,砷酸钠在酸性条件下可使碘化钾氧化为单质碘,同时生成亚砷酸钠(Na3AsO3)和水,这个反应的离子方程式为______________________________ 。
23.
已知NH4+与HCHO在水溶液中有如下反应: 4NH4++6HCHO→(CH2)6N4+4H++6H2O。
现有一失去标签的铵盐氮肥。为测定其含氮量,今称取2.00 g样品溶于水,加入足量的HCHO溶液,共配得100 mL溶液,从中取出10 mL,滴入酚酞后,再逐滴加入0.100 mol/L NaOH溶液,当滴至25.00 mL时溶液呈现出了粉红色,且在半分钟内未褪色,该铵盐中氮的质量分数为
A. 0.175 B. 0.177 C. 0.350 D.无法计算
22.下列物质的水溶液中加入Ba(OH)2溶液产生沉淀,再加入过量氨水沉淀溶解,溶液又变澄清的是
A.AgNO3 B.MgCl2 C.Al2(SO4)3 D.NaHCO3
21.生物固氮是指
A.生物从土壤中吸收含氮养料 B.豆科植物根瘤菌将含氮化合物变为植物的蛋白质
C.将氮转变为硝酸及其它氮的化合物 D.将空气中的N2转变为含氮化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com