
题目列表(包括答案和解析)
17. (13分)右图是某学校实验室从化学试剂商店买回的硫酸试剂 标签上的部分内容。某次学生实验需要0.5mol/LH2SO4溶液480ml,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
(13分)右图是某学校实验室从化学试剂商店买回的硫酸试剂 标签上的部分内容。某次学生实验需要0.5mol/LH2SO4溶液480ml,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
①实验中除了量筒、烧杯外还需要的其它仪器有: ;
②计算所需浓硫酸的体积是 mL;若该硫酸与等体积的水
混合时,所得溶液中溶质的质量分数 49%(填写“<”、“=”或“>”);
③配制过程中需先在烧杯中将浓硫酸进行稀释。稀释时操作方法是: ;
④下列操作会引起所配浓度偏大的是(填写字母) 。
A、用量筒量取浓硫酸时,仰视量筒的刻度
B、容量瓶未干燥即用来配制溶液
C、浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D、往容量瓶转移时,有少量液体溅出
E、烧杯未进行洗涤
F、定容时俯视刻度线
G、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
16.将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则( )
A.反应过程中得到6.72L的气体(标准状况)
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8g的沉淀
D.最终得到的溶液中c(NaCl)=1.5mol/L
第Ⅱ卷(非选择题 共86分)
15.X+、Y+、M2+、N2-均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系是:N2->Y+、Y+>X+、Y+>M2+,下列比较正确的是( )
A.原子半径:N可能比Y大,也可能比Y小
B.M2+、N2-核外电子数:可能相等,也可能不等
C.原子序数:N>M>X>Y
D.碱性:M(OH)2>YOH
14.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5 NA
B.1 mol Na2O2与足量的水反应,转移的电子数为2NA
C.常温、常压下,0.2mol的SiO2所含分子数为0.2NA
D.常温常压下,124 g P4含有P-P键的个数为6NA
13.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是( )
A.物质HClO4的氧化性大于HClO3
B.变蓝的淀粉碘化钾试纸褪色可能发生的反应:
5C12+I2+6H2O=12H++10Cl-+2IO3-
C.若化学计量数a=8,b=3,则该反应转移电子数为20e-
D.氯酸分解所得O2和C12的物质的量之比是确定不变的
12.下列离子方程式书写正确的是( )
A.澄清石灰水中加入盐酸:Ca(OH)2+2 H+=2H2O+Ca2+
B.硫酸氢钠溶液中逐滴加入氢氧化钡溶液,至溶液恰好呈中性:
Ba2++OH-+SO42-+H+=BaSO4↓+H2O
C.碳酸钠和碳酸氢钠的混合溶液中滴加少量稀硫酸:HCO3-+H+=CO2↑+H2O
D.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
11.恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应:
2A(g) 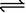 B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是( )
B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是( )
A.若x=1,则p>a B.若x=2,则p<a
C.若x=3,则p=a D.若x=4,则p≥a
10.下列有关说法正确的是( )
A.物质熔沸点的高低顺序是:晶体硅>氯化钠>冰>氖气
B.微粒半径由大到小顺序是:H->Li+>H+
C.溶液中结合H+能力由强到弱的顺序是:SO42- >H2PO4->CH3COO->HCO3-
D.CO2、HClO、CF4、PCl3四种物质分子中的所有原子都满足最外层为8电子的稳定结构
9.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是( )
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
③铝和硫直接化合可以得到Al2S3;铁和硫直接化合也可以得到 Fe2S3
④不能用电解熔融的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁
A.①③④ B.②③ C②③④ D.①②③④
8.现有t℃时质量分数为a %的KNO3溶液m g,将其分成质量比为1∶2的甲、乙两份溶
液。甲溶液蒸发5 g水,恢复到原温度时析出晶体2 g;乙溶液蒸发12 g水,恢复到原
温度时析出晶体5 g。则t℃时,KNO3溶解度为( )
A.41.7 g B.50 g C.40 g D.60 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com