
题目列表(包括答案和解析)
29、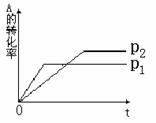 (4分)已知反应:aA(g) +
bB(g)
(4分)已知反应:aA(g) +
bB(g) 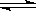 cC(g) 根据图形推测:
cC(g) 根据图形推测:
(1) P1 _____P2 ( 填 > 或 < )
(2) a + b _______c ( 填 > 或 < )
22(8分).钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l)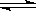 NaCl(l)+K(g) △H>0
NaCl(l)+K(g) △H>0
|
压强(kPa) |
13.33 |
53.32 |
101.3 |
|
K的沸点(℃) |
590 |
710 |
770 |
|
Na的沸点(℃) |
700 |
830 |
890 |
|
KCl的沸点(℃) |
|
|
1437 |
|
NaCl的沸点(℃) |
|
|
1465 |
该反应的平衡常数可表示为:K=C(K),各物质的沸点与压强的关系见上表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 。
(3)常压下,当反应温度升高900℃时,该反应的平衡常数可表示为:K=
23.(6分)向纯碱溶液中滴入酚酞溶液,观察到的现象是 ,原因是
若再向该溶液中滴入过量氯化钙溶液,观察到的现象是 原因是
|
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
|
|
|
|
|
|
|
|
|
|
三 |
四 |
五 |
六 |
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
班级______________ 姓名______________ 成绩_____________
21. 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)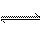 2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
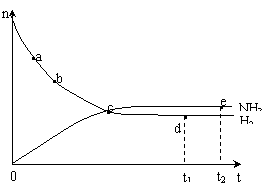
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
高三上学期化学专业考试卷
20. 室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D pH=4的盐酸和pH=l0的氨水
19.关于小苏打水溶液的表述正确的是
A. c(Na+) = c(HCO3-)+ c(CO32-)+ c(H2CO3)
B.c(Na+) + c(H+)= c(HCO3-)+ c(CO32-)+ c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离有:NaHCO3 == Na+ + HCO3-,HCO3- 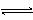 H+ +
CO32-
H+ +
CO32-
H2O
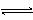 H+ +
OH-
H+ +
OH-
18. 下列各组热化学方程式程中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(s)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A ① B ④ C ②③④ D ①②③
17.某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其[H+]=10-2 mol·L-1,在该溶液中可以大量存在的阴离子是
A.SO42- B.NO3- C.SCN- D.CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com