
题目列表(包括答案和解析)
12.下列离子方程式正确的是 ( )
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+ H2O
B.澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
C.钠与水反应Na+2H2O=Na++2OH-+H2↑
 D.碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
D.碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
11. 下列说法中,不正确的是 ( )
A. 在NaAlO2溶液中,HSO3-不可能大量存在
B. 在0.1mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C. 在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
D. 室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
10.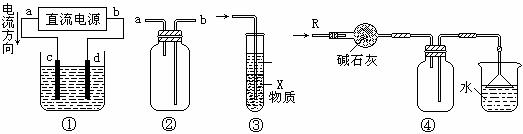 关于下列各装置图的叙述中,不正确的是
( )
关于下列各装置图的叙述中,不正确的是
( )
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
9.核磁共振(NMR)技术已广泛用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可以产生NMR现象 ( )
A.18O 、19O、24Mg B.12C、31P、27Al
C.第VA族原子 D.第三周期原子
8、近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在
470℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是 ( )
A. 由二氧化碳合成金刚石是化学变化
B. 金刚石是碳的一种同位素
C. 钠被氧化最终生成碳酸钠
D. 金刚石中只含有非极性共价键
7、 从宏观方面来说物质由元素组成,从微观方面来说物质由粒子构成。下列说法中不正确的是
( )
从宏观方面来说物质由元素组成,从微观方面来说物质由粒子构成。下列说法中不正确的是
( )
A. 26Fe与26Fe互为同位素
B.只由一种分子组成的物质一定为纯净物
C.质子数等于电子数的某微粒,可能是一种分子或一种离子
D.46gNO2和46gN2O4含有的原子数相等
6.25 ℃时,相同物质的量浓度的下列溶液中,水的电离程度排列顺序正确的是 ( )
①NaCl ② NaOH ③ HCl ④ (NH4)2SO4
A.④>①>②>③ B.②=③>①>④
C.④>①>②=③ D.④>②>①=③
5.下列叙述不正确的是 : ( )
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.将Cl2和SO2分别通入到品红溶液中,均能使品红溶液退色
C.反应AgCl + NaBr==AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
4. 已知NaHA溶液呈强酸性、NaHB溶液呈弱碱性、NaC溶液呈中性。若测得三种溶液(1)NH4HA,(2)NH4HB,(3)NH4C中的C(NH4+)均为0.05mol/L,则这三种盐的物质的量浓度关系为 ( )
A.(1)=(2)=(3) B.(2)>(3)>(1)
C.(2)>(1)>(3) D.(1)>(3)>(2)
3、氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质, 被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C2 AlN + 3 CO 下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com