
题目列表(包括答案和解析)
24.(8分)已知X、Y、Z为三种由短周期元素构成的粒子,每mol粒子都有10mol电子,其结构特点如下:
|
|
X |
Y |
Z |
|
原子核数 |
单核 |
四核 |
双核 |
|
粒子的电荷数 |
1个单位正电荷 |
0 |
1个单位负电荷 |
物质A由X、Z构成,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
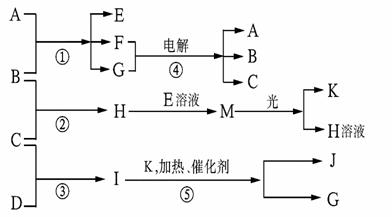
请回答下列问题:
(1)A的化学式为 ;D的结构式为 。
(2)完成下列反应的离子方程式:
反应① 。
反应④ 。
(3) 若J气体浓度过高可导致高铁血红蛋白血症,且污染大气等。但J也有不少的用途,如
(举出一例)。
23.(15分)学习元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请根据要求完成下列部分实验报告。
I 课题名称:___________________________________________________________。
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:
(1)在氧化物的回收过程中,要进行的操作是 、洗涤、 、称量。
(2)实验编号3的实验中KClO3的分解率为___________________%(保留一位小数)
(3)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________,可用___________________试纸检验。上述异常现象产生的原因是_____________________________________________________。
VI 实验结论:_____________________________________________________________。
22.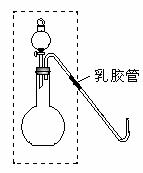 (11分)实验室中利用电石和水反应制取一定量乙炔进行其性质实验,最后点燃(如图)。回答下列问题:
(11分)实验室中利用电石和水反应制取一定量乙炔进行其性质实验,最后点燃(如图)。回答下列问题:
①实验前,应检查气体发生装置(如图虚线框内装置)的气密性。某同学双手捂住烧瓶,把导气管伸入水面下,但无任何气泡冒出,则出现此原因可能是 。
A.烧瓶容积较大
B.导气管伸入水面下太深
C.没有关闭分液漏斗的活塞
D.橡皮塞上的孔与导管不匹配或橡皮塞与分液漏斗不匹配
②为了制取乙炔,检查装置气密性后,先往烧瓶中加入 ,再往漏斗中加入 ,然后再 。
③点燃乙炔会产生浓烈的黑烟,所以在实验时点燃后要迅速熄灭火焰。试用一种简单的安全的操作方法熄灭火焰: 。
④该气体发生装置还可以制取O2、NH3等气体,写出其中的一条化学反应方程式:
。
21.(6分)下列有关实验的叙述,不正确的是(填序号) 。
①蒸干FeCl3溶液可以得到无水的氯化铁
②在氢氧化铁胶体中加少量硫酸会产生沉淀
③无法用分液漏斗将甘油和水的混合物分离
④用干燥洁净的玻璃棒蘸取溶液,滴在湿润的pH试纸上,试纸完全变色后,跟标准比色卡比较
⑤滴定时左手控制滴定管,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
⑥硝酸、溴水不可以长期盛放在棕色滴瓶中
20.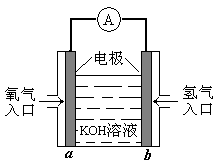 右图为一种氢氧燃料电池的示意图。关于该氢氧燃料电池的说法中正确的是
右图为一种氢氧燃料电池的示意图。关于该氢氧燃料电池的说法中正确的是
A.a电极上发生的电极反应式为:
O2+4H++4e-=2H2O
B.b电极上发生的电极反应为还原反应
C.外电路中电子从b电极流向a电极
D.电池工作时电池内部的电解质溶液pH不变
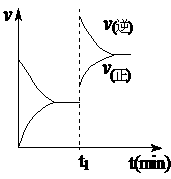
19. 右图为化学反应:4NH3 (g)+5O2 (g) 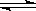 4NO(g)+6H2O (g) ;△H<0 在一容积不变的密闭容器中反应的v-t图。下列叙述不符合右图
4NO(g)+6H2O (g) ;△H<0 在一容积不变的密闭容器中反应的v-t图。下列叙述不符合右图
 所给信息的是
所给信息的是
A.t1时,向容器中通入一定量的NO气体
B.t1时,缩小容器的体积
C.t1时改变外界单一条件时,该反应的平衡常数
一定减小
D.从t1开始到新的平衡建立的过程中,平衡向逆
反应方向移动
18.下列叙述正确的是
A.元素的非金属性越强,其最高价氧化物对应水化物的酸性、氧化性也越强
B.等质量的铜分别和过量的浓硫酸、浓硝酸充分反应,则反应过程中转移的电子数之比为1 : 1
C.已知C和CO的燃烧热分别为Q1 、Q2 kJ/mol,则1 molC与0.5 molO2完全反应生成(相同条件下)CO时的△H为:(Q2-Q1)kJ/mol
D.凡有单质参加或生成的化学反应一定属于氧化还原反应
17.a mol FeS 与 mol FeO投入到V L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)×189g
C.(a+b)mol D.(c V-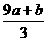 )mol
)mol
16.
常温下,0.1 mol·L-1某一元酸(HA)溶液中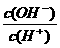 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.0.1mol/L的NaA溶液中的离子浓度大小关系为:
c(Na+)>c(A-) >c(H+)>c(OH-)
C.该溶液中水的离子积常数为1×10-22
D.用0.1 mol·L-1NaOH溶液V1 L 与0.1 mol·L-1该一元酸(HA)V2 L溶液混合,若混合溶液的pH = 7,则V1<V2
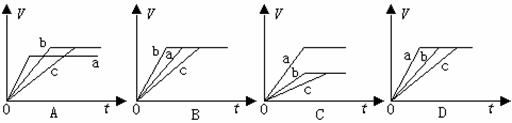
15. 等质量的三份铁a、b和c,分别加入稀H2SO4中,a中同时加入适量CuSO4溶液,c中加入适量CH3COOK。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com