
题目列表(包括答案和解析)
10. ( 德州市) 下图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
|
|
X |
|
|
|
Y |
|
|
Z |
M |
|
A. 非金属性:Y>Z>M
B. 原子半径:M>Z>Y
C. 气态氢化物的稳定性:Y<M<Z
D.
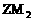 分子中各原子的最外层电子均满足
分子中各原子的最外层电子均满足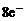 稳定结构
稳定结构

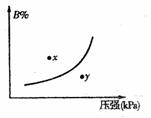 11.(济宁市)反应mA(固)+nB(g) pC(g),△H<0,在一定温度下,
11.(济宁市)反应mA(固)+nB(g) pC(g),△H<0,在一定温度下,
平衡时B的体积分数(B%)与压强变化的关系如图所示,下列
叙述中一定正确的是 ( )
①m+n>p
②x点表示的正反应速度大于逆反应速率
|
④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A.①②⑤ B.只有②④ C.只有①③ D.只有①③⑤
9.(崇文区一模)现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1L、V2L、V3L等
浓度的盐酸混合,下列说法中正确的是 ( )
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1>V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后,则NaOH溶液pH最大
8.(崇文区一模)下列叙述中不正确的是 ( )
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应:
 CH3COO-+H2O
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
CH3COO-+H2O
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
B.在0.1mol/LNa2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO2-3)+c(HCO3-)
C.在0.1mol/LNH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-)
D.将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:
c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-)
7、(全国统考雅礼卷)对于下列置换反应,其中不能在溶液中进行的是 ( )
A.非金属单质置换出金属单质 B.非金属单质置换出非金属单质
C.金属单质置换出金属单质 D.金属单质置换出非金属单质
6. ( 德州市) 下列对阿佛加德罗常数数值描述最准确的是 ( )
A.
720g 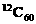 所含的分子个数
B. 1mol HCl溶于水中
所含的分子个数
B. 1mol HCl溶于水中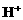 的个数
的个数
C.
22.4L 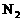 所含的分子数
D. 常温常压下,0.1mol羟基(-OH)所含电子的个数
所含的分子数
D. 常温常压下,0.1mol羟基(-OH)所含电子的个数
12.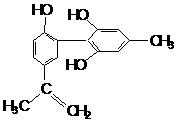 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
( )
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1 mol该物质与浓溴水和H2反应时最多消耗Br2和H2分别为4 mol、 7 mol
D.该分子中的所有原子有可能共平面
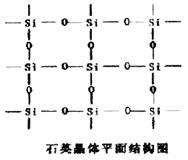
11.设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )
A.已知石英晶体的平面结构如右图所示,60g石英中含有的硅原
子数为NA
B.将铜片溶解于稀硝酸中,每产生lmol气体转移电子数目为3NA
C.34g10%的双氧水中,含有的共价键数目为4NA
D.28gN2与CO的混合气体所含的原子数目为2NA
29.(14分)已知Fe3+的氧化性大于Cu2+,据此性质,某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。用离子方程式表示其化学原理 。
某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50.00 mL废液,向其中加入0.64 g金属铜,金属铜全部溶解;又取50.00 mL 废液,向其中加入足量的AgNO3溶液,析出沉淀43.05 g。请回答以下问题 (此题的计算结果注意有效数字,即保留两位小数) :
(1)该厂生产后废液中所含金属离子有________________________;
(2)该厂原来使用的FeCl3溶液的物质的量浓度 (反应前后溶液的体积变化忽略不计);
(3)若向500.00 mL废液中加入足量的稀硝酸,在标准状况下生成NO气体4.48 L,则原废液中各金属阳离子的物质的量浓度之比为(要表示出对应的离子)__________________;
(4)另取500.00 mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围为 。
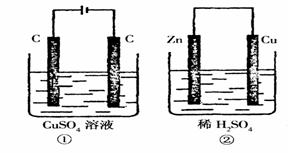 附10.如图所示的两个实验装置中,溶液的体积均为200mL,
附10.如图所示的两个实验装置中,溶液的体积均为200mL,
开始时电解质溶液的浓度均为0.1mol/L,工作一段时间
后, 测得导线中均通过0.02mol电子,若不考虑盐的
水解和溶液体积的变化,则下列叙述中正确的是:( )
A.产生气体的体积:①>②
 B.电极上析出物质的质量:①>②
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:①中阳极:4OH--4e-=O2↑+2H2O;②中负极:2H++2e-=H2↑
28. 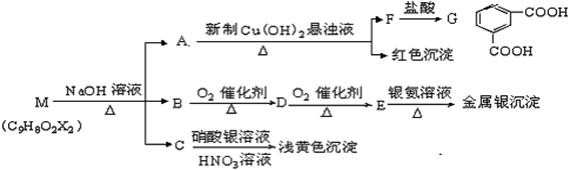 (15分)现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应,试回答下列问题:
(15分)现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应,试回答下列问题:
(1)A中所含的官能团为 (填名称),上述转化中其中属于氧化反应的共有 步
(填数字);M与NaOH溶液共热时的反应类型是 反应。
(2)M的结构简式为 。
(3)写出下列反应的化学方程式:①B→D: ;
②G与足量CH3CH2OH在浓硫酸催化加热时的反应:
(4)A酸化得到H,H有多种芳香族化合物的同分异构体,其中,要求同时满足以下条件:
①在苯环上只有一个取代基;②1molA与足量NaOH溶液反应,需要消耗2molNaOH。③该物质能发生银镜反应。该有机物与银氨溶液反应的化学方程式:
27.(16分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
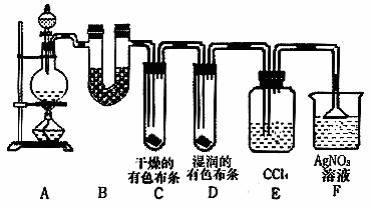
(1)下列方法中,可制得氯气的正确组合是 。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热;
③次氯酸钠和浓盐酸混合; ④K2Cr2O7和浓盐酸混合;
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥ B.②④⑥ C.①④⑥ D.全部可以
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
。
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 试剂。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com