
题目列表(包括答案和解析)
20.(13分)某学生计划用37%,密度为1.19 g/ml的浓盐酸配制0.2mol/L的稀盐酸500mL,若实验仪器有: A、100mL量筒 B、托盘天平 C、玻璃棒 D、100mL容量瓶 E、10mL量筒 F、胶头滴管 G、100mL烧杯 H、500mL容量瓶
(1)实验时应选用的仪器是(填编号):
(2)在容量瓶的使用方法中,下列操作不正确的是(填编号):
A、使用容量瓶前检查它是否漏水;
B、容量瓶用蒸馏水洗净后,不经干燥直接用于配溶液;
C、配制溶液时,将所取液体或固体直接倒人容量瓶中,缓慢加入蒸馏水到液面接近容量瓶刻度lcm一2cm处时,改用滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切;
D、将容量瓶倾斜,使溶解的溶液直接沿容量瓶内壁倾注入容量瓶;
E、当液面达刻度线后,盖好容量瓶的瓶塞,将容量瓶反复颠倒、摇匀。
(3)该学生用上述准确配制的0.2mol/L的盐酸通过中和滴定方法来测定某NaOH和 Na2CO3,混合溶液中两种溶质的物质的量浓度。设计以下两个实验方案:(已知指示剂发生颜色变化的pH范围分别是:甲基橙:3.1-4.4,酚酞:8.2-10。常温下,二氧化碳饱和溶液的pH约为3.9)
方案I:①取混合溶液VmL,加人足量BaCl:溶液后,以酚酞为指示剂,用上述盐酸滴定,到滴定终点时耗用盐酸V。mL;②再另取混合溶液VmL,以甲基橙为指示剂,用上述盐酸滴定,到滴定终点时,耗用盐酸V,mL
方案II:操作方法与[方案I]相同,但①②两过程所用的指示剂作了调换,即①以甲基橙为指示剂,②以酚酞为指示剂。假设以上操作都是准确的,试评价两个方案的合理性,若合理,只写出计算c(NaOH)、c(Na2CO3)物质的量浓度的数学表示式;若不合理,请简要说明理由.
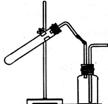
19.(8分)右上图是某学生设计的制取和收集某些气体的实验装置(可加热)。 使用该装置制备和收集以下气体,可用排空气法收集的是 ,可用排水法收集的是 (填编号)。
A、用Zn与稀盐酸反应制H2 B、用MnO2与双氧水反应制O2
C、用MnO2与浓HCl反应制C12 D、用Mn02与KCl03反应制O2
E、用CaCO3与稀盐酸反应制CO2 F、用Cu与稀HNO,反应制NO
G、用固体NH。C1和消石灰制NH3
18. 甲、乙两容器都发生反应2A(g)+B(g)==xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为
甲、乙两容器都发生反应2A(g)+B(g)==xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为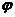 、物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为
、物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为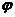 、物质的量为n2。下列说法中正确的是
、物质的量为n2。下列说法中正确的是
A.若甲、乙两容器均为恒容容器,则x必等于2
B.若甲、乙两容器均为恒压容器,则x必等于3
C.若甲为恒压容器、乙为恒容容器,且x≠3,则n1必大于n2
D.若甲为恒容容器、乙为恒压容器,且x=3,则n1必大于n2
第Ⅱ卷(共78分)
17.A、B分别是M元素的碳酸盐和碳酸氢盐,将一定量A、B的混合物与足量盐酸反应,消耗HCl与生成CO2的物质的量之比为3:2。已知M可能是ⅠA族或ⅡA族元素,则混合物中A、B的物质的量之比可能是
A.3﹕1 B.2﹕1 C.1﹕2 D.1﹕1
16.A和B是短周期元素,A2一与B+的核外电子总数之差为8,则下列说法正确的是
A.A和B的原子序数之差为8 B.A和B原子的最外层电子数之和为8
C.A和B原子的最外层电子数之差为7 D.A和B原子的核外电子数总和可能为11
15.与铁相似,金属锡能溶于盐酸生成氯化亚锡,氯化亚锡又能被氯化铁氧化为氯化锡。则下列有关微粒氧化、还原能力的比较中,正确的是
A.氧化能力:Sn4+<Sn2+ B.氧化能力:Fe3+<Sn4+
C.还原能力:Fe2+< Sn2+ D.还原能力:Fe < Sn
14.下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钠溶液与明矾溶液混合:
Ba2++3OH-+Al3++ SO42-=BaSO4↓+Al(OH)3↓
B.向苯酚钠溶液中通人少量CO2:C6H5O-+CO2+H2O→C6H5H↓+HCO3-
C.向硫代硫酸钠溶液中滴人过量稀硫酸:4H++2S2O32-=3S↓+ SO42-+2 H2O
|
13.巳知25℃、l0lkPa下,石墨、金刚石燃烧的热化学方程式分别为;
C(石墨)+O2(g)=CO2(g);△H= -393.51kJ/mol C(金刚石)+O2(g)=CO2(g);△H=-395.4l kJ/mol
据此推理所得到的下列结论正确的是
A.金刚石的燃烧热比石墨的燃烧热小 B.石墨晶体中碳碳键的强度小于金刚石
C.石墨的能量比金刚石的能量高 D.由石墨制备金刚石-定是吸热反应
12.下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀。试组离子可能是
A.Na+、Cu2+、NO3-、CO32- B.Ba2+、K+、Cl-、HCO3-
C.Fe2+、Na+、SO42-、NO3- D.Mg2+、NH4+、SO42-、Cl-
11.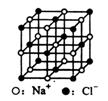 用NA表示阿伏加德罗常数,下列说法中正确的是
用NA表示阿伏加德罗常数,下列说法中正确的是
A.乙烯和丙烯的混合物1.4g中含有0.1NA个碳原子
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
C.23.4gNaCl晶体中含有0.1NA个右图所示的结构单元
D.电解精炼铜时转移0.1NA个电子时阳极溶解3.2g铜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com