
题目列表(包括答案和解析)
19.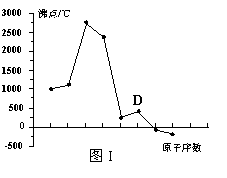 (8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
(8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
|
化合物 |
甲 |
乙 |
丙 |
|
原子个数比 |
B∶A=1∶3 |
C∶A=1∶2 |
D∶A=1∶2 |
(1)元素D在元素周期中的位置 。
(2)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到稳定结构,则X的化学式为 ;X的熔点 金刚石(填“大于”、“等于”或“小于”)。
(3)写出图I中沸点最高的单质与NaOH溶液反应的离子方程式 。
(四)红色沉淀探究 该同学设计了四种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化。
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣。
方案Ⅲ:称得干燥坩埚a g ,取红色粉末置于坩埚中再称得质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为c g,比较a、b、c的关系。
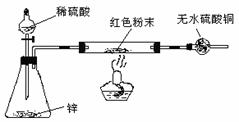 方案Ⅳ:装置如右图所示:(夹持仪器略去)试回答下列问题:
方案Ⅳ:装置如右图所示:(夹持仪器略去)试回答下列问题:
(1) 请你评价方案Ⅰ和方案Ⅱ。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
评价方案Ⅰ
评价方案Ⅱ
(2)方案Ⅲ中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O。
(3)方案Ⅳ中,要测定红色粉末的成分,必须测定下列哪些物理量 (填序号)。
①通入氢气体积 ② 反应前,红色粉末+反应管的总质量 ③实验前干燥管的质量④完全反应后,红色粉末+反应管的总质量 ⑤反应管的质量 ⑥ 锌粒质量 ⑦ 稀硫酸的物质的量浓度 ⑧实验后干燥管的质量 ⑨实验条件下的大气压强和室温
(4)有人提出:方案Ⅳ中,在氢气发生器与反应管之间应加一个干燥装置,你认为 (选填“需要”或“不需要”),简述理由 。
(三)制备红色沉淀:①制备氢氧化铜悬浊液 ②氢氧化铜悬浊液与葡萄糖共热 ③过滤、洗涤、低温烘干得红色粉末。
(二)查阅资料:①Cu2O属于碱性氧化物; ②Cu+在酸性条件下能发生自身氧化还原反应;
③在空气中灼烧Cu2O能生成CuO。
(一)提出猜想: 。
17.(10分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)不用普通滤纸过滤器过滤KMnO4溶液的原因是_______________________________;
(2)如何保证在700C-800C条件下进行滴定操作:______________________________;
(3)准确量取一定体积的KMnO4溶液用________________;
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用___________(填序号);
A.H2C2O4•2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
(5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将_____(填“偏高”或“偏低”)
18.(12分)某同学对课本实验结论:“葡萄糖与新制氢氧化铜共热生成红色的Cu2O沉淀”提出质疑,认为红色沉淀不一定就是氧化亚铜。为了确定红色沉淀的成分,开展了研究。
16.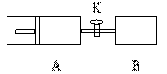 如图,容器A左侧是可平行移动的活塞。向A中充入1molX的1molY,向B中充入2molX和2molY,起始时A、B的体积都等于a L。在相同温度下,关闭活塞K,使两容器中各自反应:
如图,容器A左侧是可平行移动的活塞。向A中充入1molX的1molY,向B中充入2molX和2molY,起始时A、B的体积都等于a L。在相同温度下,关闭活塞K,使两容器中各自反应:
X (g)+ Y(g) 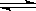 Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是
Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是
A.反应速率:v(B) >v(A)
>v(A)
B.A容器中X的转化率为 20%
C.平衡时的压强:PB=2PA
D.若打开K,则达到新的化学平衡时,A的体积为2.6a L
15.下列各溶液中,微粒的物质的量浓度关系正确的是
A.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
B.在0.1mol·L-1Na2CO3溶液中:c(OH-)==c(HCO3-)+c(H+)+ c(H2CO3)
C.pH>7的NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN-) >c(OH-) >c(H+)
D.pH>7的CH3COONa与NaOH的混合溶液中一定有:c(Na+)>c(CH3COO-) >c(OH-) >c(H+)
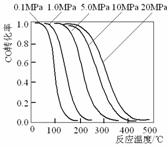
14.
 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如右图;目前正在开发的新法是:
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO-ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数如右图;目前正在开发的新法是:
 2CH4+ O2
2CH3OH 。下列关于新法和旧法的说法正确的是
2CH4+ O2
2CH3OH 。下列关于新法和旧法的说法正确的是
A.旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应
B.旧法生产中,选择合适催化剂时,可推测高压法合成比低压法合成更
有发展优势。
C.新法与旧法相比,原料丰富并可直接从天然气中获得
D.新法生产中,需控制V(CH4)/V(O2)=9∶1,目的是提高空气中氧气的转化率
13.甲、乙、丙、丁为短周期元素形成的粒子,它们的电子总数相等。已知四种粒子中,甲、乙为分子,丙为双原子构成的负二价阴离子,丁为原子。则下列说法正确的是
A.丙与钙离子组成的化合物为离子化合物
B.丁原子一定是稀有气体原子
C.甲、乙的分子中可能有非极性分子
D.丙与钙离子组成的化合物和水反应生成的气体一定是乙炔
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com