
题目列表(包括答案和解析)
6、顺12.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l) == Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子 B.电池正极为MnO2 ,发生氧化反应
C.电池工作时,电子由Zn 极通过外电路流向MnO2极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
北京市各城区二模化学选择题练习五
(原子结构周期化学键晶体)
5、西10.下列叙述正确的是
A.电镀时应把镀件置于电解槽的阳极 B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.目前已研制成功铝-空气电池,铝为电池的负极
D.原电池的负极和电解池的阳极所发生的反应同属还原反应
4、崇6. 如右图所示的两个实验装置中,溶液的体积均
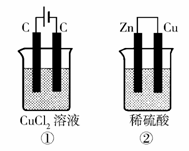
为200mL,开始时电解质溶液的浓度均为0.1mol/L,
工作一段时间后,测得导线中均通过0.02mol电子,
若不考虑盐的水解和溶液体积的变化,则下列叙述
中正确的是
A.产生气体的体积:①>②
B.溶液的pH变化:①增大,②不变
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极 2Cl--2e- Cl2
↑
②中负极 2H++2e- H2↑
3、海8.下列叙述不正确的是
A.电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应
B.电解法精炼铜时,纯铜作阴极,Cu2+ 发生还原反应
C.电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液
D.铜锌原电池中,锌作负极,电子从锌极流向铜极
2、 宣12.
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
宣12.
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是
A.放电时锌做负极 B.充电时氢氧化铁被氧化
C.放电时溶液的碱性增强D.放电时每转移3 mole-,有2mol FeO42-被还原
1、东8.新型的乙醇电池结构如图所示,它用磺酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全。已知电池总反应式为
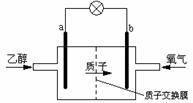 C2H5OH +3O2 =2CO2
+3H2O。下列说法不正确的是
C2H5OH +3O2 =2CO2
+3H2O。下列说法不正确的是
A.a极为电池的负极,该电极发生氧化反应
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应式为 O2 + 2H2O +4e-= 4OH-
D.电池工作时,1mol乙醇被氧化转移12 mol电子
2、崇7. 根据相关化学原理,判断下列正确的是 A.若X的质子数为a,中子数为b,则X的质量数为:a - b
B.若A2+2D- 2A-+D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
北京市各城区二模化学选择题练习四(电化学)
1、丰7.有下列三个反应:①Cl2 + FeI2 = FeCl2 + I2 ②2Fe2+ + Br2 = 2Fe3+ + 2Br-
③Co2O3 + 6HCl = 2CoCl2 + Cl2↑+ 3H2O 下列说法正确的是
A.①②③中的氧化产物分别是I2 、Fe3+、CoCl2
B.根据以上方程式可以得到氧化性Cl2 >Fe3+> Co2O3
C.根据反应①一定可以推理得到Cl2 + FeBr2 = FeCl2 +Br2
D.在反应③中当1molCo2O3 参加反应时,有2molHCl被氧化
10、顺11.右图是某有机物分子的简易球棍模型,其中含C、H、O、N四种元素。下列关于该有机物的说法中错误的是
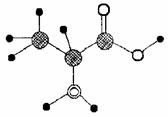 A.分子式为C3H7O2N
A.分子式为C3H7O2N
B.能发生取代反应
C.不能跟NaOH溶液反应
D.能跟NaHCO3溶液反应放出CO2
北京市各城区二模化学选择题练习三(氧化还原)
9、顺10.某溶液中可能存在Br-、CO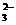 、SO
、SO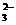 、Al3+、I-、Mg2+、Na+等七种离子中的几种。现取该溶液进行实验,有如下实验现象:
、Al3+、I-、Mg2+、Na+等七种离子中的几种。现取该溶液进行实验,有如下实验现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色无味气体产生
②向所得橙色溶液中滴加足量BaCl2溶液,无沉淀生成
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色
据此可以推断,该溶液中肯定不存在的离子是
A.Mg2+、Na+、CO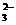 、I- B. Al3+、Mg2+、SO
、I- B. Al3+、Mg2+、SO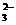 、I-
、I-
C.Al3+、Na+、SO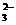 、I-
D.Al3+、CO
、I-
D.Al3+、CO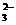 、Br-、SO
、Br-、SO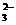
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com