
题目列表(包括答案和解析)
10.(12分)(1)配平下列离子方程式:Ix- + Cl2 + H2O -→Cl- + IO3- + __________
在反应中,若消耗Ix- 与 Cl2 物质的量之比为1:8,则 x =__________。
(2)向MnSO4和硫酸的混合溶液中加入K2S2O8(过二硫酸钾),溶液会发生如下反应:
Mn2+ +S2O82-+H2O -→MnO4- +SO42-+H+ 若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol。
(3)若该反应所用的硫酸锰改为氯化锰,当它与过量的过二硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有____________

|


 11.(10分)用A、B两种常见化合物组成的混合物,其焰色反应均呈黄色,相互转化关系如下图(其它物质均已略去)。回答下列问题。 加稀H2SO4
11.(10分)用A、B两种常见化合物组成的混合物,其焰色反应均呈黄色,相互转化关系如下图(其它物质均已略去)。回答下列问题。 加稀H2SO4
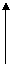
|

|



 (2)B加热产生D的化学方程式为:______ 加稀H2SO4
(2)B加热产生D的化学方程式为:______ 加稀H2SO4

|
 B加稀H2SO4产生D的离子方程式为:______ 加水
通入气体D
B加稀H2SO4产生D的离子方程式为:______ 加水
通入气体D
(3)A、B加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为____
(填数字)
9.在密闭容器中充入CO2 、CO、CH4的混合气体共m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体的质量增重m g,则CO2与CH4的体积比为( )
A.3:1 B.2:1 C.1:1 D.缺少条件,无法求算
8.取相同体积的KI、Na2S、FeBr2溶液,分别通入适量Cl2,当反应恰好完成时,3种溶液消耗Cl2的体积相同(同温同压下),则KI、Na2S、FeBr2溶液的物质的量浓度之比为( )
A.1:1:2 B.1:2:3 C.6:3:2 D.2:1:2
7.将16.8gNaHCO3与一定量的Na2O2固体混合,在加热的条件下使其反应,经测定没有Na2O2剩余,则最后所得固体的物质的量为( )
A.0.1mol-0.2mol之间 B.0.1mol-0.4mol之间 C.0.2mol-0.4mol之间 D.大于0.4mol
6.硫氰化学式为(SCN)2,结构式为N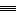 C-S-S-C
C-S-S-C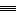 N,其分子及阴离子 (SCN-)的性质都与卤素相似。下列关于硫氰的叙述不正确的是(
)
N,其分子及阴离子 (SCN-)的性质都与卤素相似。下列关于硫氰的叙述不正确的是(
)
A.与水反应可生成两种酸 B.与氢氧化钾溶液反应产物之一为KSCN
C.NaSCN与AgSCN受热发生分解 D.HSCN浓溶液与MnO2共热可生成(SCN)2
5.气体X可能含有NH3、Cl2、HBr、CO2中的一种或几种。已知X通入AgNO3溶液中时产生淡黄色沉淀,该沉淀不溶于稀硝酸,若将X通入澄清石灰水中,不见沉淀生成,有关气体X的成分说法正确的是( )
A.可能含有Cl2 B.一定含有CO2 C.一定含HBr D.一定不含有NH3、CO2
4.下列物质间反应的离子方程式正确的是( )
A.Fe3O4 溶于氢碘酸中: Fe3O4 +8H++2I-== 3Fe2+ + I2 +4H2O
B.次氯酸钙溶液中通入过量二氧化碳:Ca2+ + 2ClO- +H2O+CO2 == CaCO3↓+ 2HClO
C.Cl2 与FeBr2 按 1:2物质的量的比在溶液中反应:2Cl2 +2Fe2+ +2Br-== 4Cl-+2Fe3+ +Br2
D.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2 +4H+ == Fe3+ + 4H2O
3.有一种生产碘的工作方法是用亚硫酸氢钠还原碘酸盐( IO3-)。每还原出1molI2 分子,理论上需要用去亚硫酸氢纳( ) A.5mol B.2mol C.2.5mol D.1mol
2.阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
A.常温常压下,18.0g重水(D2O)所含的电子数约为10×6.02×1023
B.标准状况下,aL甲烷与乙烷混合气体中的分子数为 (a/22.4)×6.02×1023
C.标准状况下,22.4L甲苯所含的分子数约为6.02×1023
D.室温下,42.0g乙烯与丙烯的混合气体中含有的碳原子数约为3×6.02×1023
1.下列实验操作会导致实验结果偏低的是( )
①配制100g10%的CuSO4溶液,称取10gCuSO4 晶体溶于90g水中
②测定CuSO4晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的H2SO4溶液,定容时俯视容量瓶的刻度线
④中和滴定时,用含KOH的NaOH 配制成的标准溶液滴定未知浓度的HCl
A.只有② B.只有① C.②③④ D.①③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com