
题目列表(包括答案和解析)
7、CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是:
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
6. 1 L水中溶有Mg(HCO3)2和CaCl2的浓度分别为b mol/L和2b mol/L,请在下列试剂中选用最合适的一种试剂把溶液中的Mg2+、Ca2+去掉
A.NaHCO3 B.Na2CO3 C.NaOH D.Ca(OH) 2
5.下列各组中的两种溶液,不用其它试剂就可以鉴别开的是
①H3PO4,Ba(OH)2 ②FeCl3,NaOH ③NaOH,AlCl3 ④NaAlO2,HCl ⑤AgNO3,氨水
A.全部 B. ②③④ C. ②③ D. ③④⑤
3、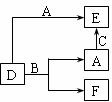 A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属。D、E、F是常见的三种氧化物,且有如图所示转化关系。则下列说法不正确的是
A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属。D、E、F是常见的三种氧化物,且有如图所示转化关系。则下列说法不正确的是
A.D、E中一定都含有A的元素 B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
4在FeCl3和CuCl2的混和溶液中,加入过量Fe粉,完全反应后,余下固体的质量与所
加Fe粉质量相等,则原混和液中FeCl3和CuCl2的物质的量浓度之比为
A.7:2 B.2:7 C.1:2 D.2:1
2.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Cl -
C.Fe3+ D.NO3 –
1.一种新型净水剂PAFC(聚合氯化铁铝,[AlFe(OH)nCl6-n]m,n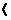 5,m
5,m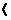 10),广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是
10),广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是
A.PAFC用于净化饮用水时,可以除去水中所有的有害物质
B.PAFC中铁显+2
C.PAFC可看作一定比例的氯化铝和氯化铁的水解产物
D.PAFC在强酸性或强碱性溶液中都能稳定存在
20.(16分)请根据以下题目的要求,完成相关问题:
Ⅰ.在BaCl2溶液中通入SO2气体至饱和无沉淀产生,然后将另一种气体A通入BaCl2溶液中,产生沉淀,则A可以是 、 、 等(要求填二种化合物和一种单质的化学式)。
Ⅱ.⑴在试管里放入一小块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。若铜片还有剩余,硫酸是否消耗完毕?其理由是___________________________________。
⑵足量的锌投入到一定量的浓硫酸中,充分反应后共收集到SO2和H22.24L(标准状况)。
①简述能产生H2的原因是 ;
②上述变化中体现浓硫酸强氧化性的反应方程式是 ;
③反应共消耗金属锌的质量为_________g。
④以上数据能否计算出消耗的硫酸的物质的量?_______(填“能”或“不能”)。
19.(15分)有两个实验小组的甲、乙同学为探究过氧化钠与二氧化硫的反应,按照物质检验(或研究物质)的基本程序,第一步他们首先应 ,得到的结论是: ;第二步:他们预测Na2O2与SO2会发生反应,并设计如下装置进行进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
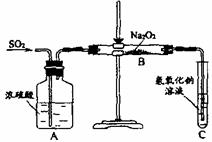 上网查找有关的资料,得到:
上网查找有关的资料,得到:
① SO2无色,有刺激性气味的气体
②BaSO4、BaSO3均难溶于水
③ SO2有还原性
SO2+ NaOH=== Na2SO3;
Na2SO3在空气中易被氧化成Na2SO4;
Na2SO3遇硝酸也能被氧化成Na2SO4;
Na2SO3+ 2HCl = 2NaCl+SO2+H2O。
请回答下列问题:
⑴第1小组甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
。
⑵请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
。
⑶第2小组乙同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,请你设计一个合理的实验方案证明其结论的正确性:
方案设计 ;
并写出所设计的方案涉及的离子方程式: 。
⑷通过上述研究过程,你得出的结论是 。
18.(16分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的重要条件及生成的水已略去),已知:
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体;
(b)反应①、②是化工生产中的重要反应;
(c)化合物E是形成酸雨的污染物之一,化合物K是常见的氮肥;
(d)化合物L具有漂白性,可由Cl2与过量的NaOH溶液反应制得;
(e)化合物J由两种元素组成,其相对分子质量为32。
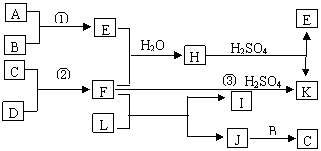
请按要求填空:
⑴反应③的化学方程式 ;
⑵C的结构式 ;H的化学式 ;
⑶L溶液与化合物E反应的离子方程式 ;
⑷写出L与F反应的化学方程式: 。
⑸写出过量的E与F的水溶液反应的离子方程式: 。
17.(15分)
下列所述各微粒都是由短周期元素组成的。
⑴由两种短周期元素组成的A、B两种分子,分子中电子总数均为18个且相对分子质量相同。若A、B能发生氧化还原反应,生成黄色的固体单质。请写出该反应的化学方程式____ __ __ __;反应中若生成1 mol固体单质,则转移电子的个数约为 。
⑵己知肼(H2N-NH2)和甲胺(CH3-NH2)都是18个电子的分子,根据肼和甲胺的结构特点,写出两种具有18个电子的有机化合物的结构简式 __ ___, 。
⑶有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。W与Z为同周期;W和Y不属同一主族;Y元素原子最外层电子数占核外总电子数的3/4; W元素原子最外层电子比Z元素多5个电子。请写出由Z、W两元素组成的化合物的电子式 。
由X和Y两元素可形成C+、D-、E三种微粒(分子或离子),它们都分别含有10个电子,巳知它们有如下转化关系D-+C+ =2E;请写出与微粒D-组成完全相同但不带电的另一种微粒的电子式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com