
题目列表(包括答案和解析)
11.下列说法中,不正确的是
A.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-) > c(NH4+)) > c(Cu2+) > c(H+) > c(OH-)
B.在0.1mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C.在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
10.为了证实CH3COOH是弱酸,下列实验方法错误的是
A.用醋酸做导电性实验时, 灯泡很暗
B.等体积pH=5的稀盐酸和醋酸分别与NaOH溶液完全反应,醋酸消耗NaOH溶液多
C.把等体积等浓度的醋酸溶液和稀盐酸稀释1000倍,醋酸比稀盐酸的pH变化小
D.测定CH3COONa溶液的pH > 7
9.已知下列热化学反应方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = -24.8kJ/mol
Fe2O3(s)+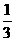 CO(g) =
CO(g) = 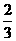 Fe3O4(s)+
Fe3O4(s)+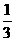 CO2(g)
△H
= -15.73kJ/mol
CO2(g)
△H
= -15.73kJ/mol
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H = +640.4kJ/mol
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H 约为
A.-218kJ/mol B.-109kJ/mol C.+218kJ/mol D.+109kJ/mol
8. 在一定条件下发生反应:3A(g) + 2B(g) xC(g) + 2D(g),在2 L密闭容器中,把4 mol A和2
mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率
xC(g) + 2D(g),在2 L密闭容器中,把4 mol A和2
mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率
vB = 0.2 mol · L – 1 · min – 1,则下列说法正确的是
A.x = 3 B.B的转化率为20%
C.平衡时气体压强是原来的0.94倍 D.达到平衡时A的浓度为1.4 mol · L – 1
7.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
6.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
氧化铜粉末 |
通过灼热的CuO粉末 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
5.下列对化学知识概括合理的是
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.氧化物不可能是还原产物,只可能是氧化产物
C.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
D.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
4.铜板上铁铆钉处的吸氧腐蚀原理如右图所示,下列有关说法中,不正确的是
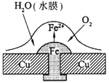 A.正极电极反应式为:2H++2e-→H2↑
A.正极电极反应式为:2H++2e-→H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
3.A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3∶4。E原子从内到外各电子层的电子数之比为1∶4∶1。则下列叙述正确的是
A.由A和C形成的一种化合物能与E的单质在一定条件下发生置换反应
B.由A、C原子和B、D原子分别构成的分子电子数相等
C.B、D两种单质相互化合的反应是不可逆反应
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
2.对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
A.化学反应速率变化时,化学平衡一定发生移动
B.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
C.正反应进行的程度大,正反应速率一定大
D.化学平衡发生移动时,化学反应速率一定变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com