
题目列表(包括答案和解析)
16.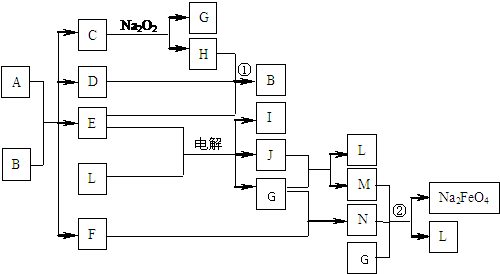 (10分) A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物。甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其化学式量分别为124、180。图中C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体;部分生成物没有列出。
(10分) A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物。甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其化学式量分别为124、180。图中C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体;部分生成物没有列出。
请填写以下空白:
(1)C的电子式为 ,甲和乙的化学式分别为 、 。
(2)反应①的化学方程式 。电解E、L混合物的离子方程式 。
(3)钢铁的表面发蓝、发黑处理是常用的防腐方法。6Na2FeO2+ NaNO2+ 5H2O = 6NaFeO2+ NH3↑+ 7NaOH是主要处理反应之一。而工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
15.(12分)请你参与下列研究性学习活动:
I.研究性学习小组甲对教材中“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”的实验结论提出质疑,他们认为红色沉淀不一定是氧化亚铜,猜想是铜和氧化亚铜的混合物。
为了确定红色沉淀的成分,开展了如下研究:
查阅资料:
氧化亚铜属于碱性氧化物;+1价的铜离子在酸性条件下易发生自身氧化还原反应;在空气中灼烧氧化亚铜生成氧化铜。
设计实验方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣。
方案3:称取该红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至固体恒重,称得质量为bg,比较a与b关系。
方案4:取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色固体析出。
(1)通过分析,你认为合理的方案是 ▲ 。
II.研究性学习小组乙针对小组甲的质疑,通过下图所示实验装置和实验步骤进行探究。
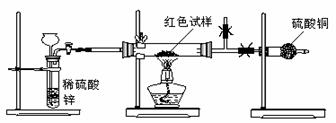 有关实验步骤:①通入氢气的体积;②反应前,红色沉淀+硬质玻管的总质量;③完全反应后红色固体+硬质玻管的总质量;④实验前,球形干燥管的质量;⑤硬质玻管的质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,球形干燥管的质量
有关实验步骤:①通入氢气的体积;②反应前,红色沉淀+硬质玻管的总质量;③完全反应后红色固体+硬质玻管的总质量;④实验前,球形干燥管的质量;⑤硬质玻管的质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,球形干燥管的质量
(2)分析上述实验装置及步骤,你认为还应采取的措施是 (填序号)。
A.在氢气发生器与硬质玻璃管之间加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的球形干燥管后再连接一个装有碱石灰的干燥管
(3)检查上述装置气密性的方法是 (简要说明操作方法、现象和结论)。
(4)上述实验步骤中,通过步骤 (填序号)有关物理量的测定,就可确定红色沉淀成分。
III.研究性学习小组丙用“绿色化学”(强调环境友好,实现零排放)的思想,将上述收集的红色沉淀制备化学试剂--蓝矾(CuSO4·5H2O)。
(5)请你帮助他们设计一个简单且符合绿色化学要求的实验方案,用实验流程图表示,并注明必要的实验操作名称)。 。
 例如:
例如:
14.根据下列有关图象,说法正确的是
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C.由图Ⅱ知,t3时采取降低反应体系压强的措施
D.Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
13.“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是重要举措之一。以下两种兴奋剂的结构分别为:
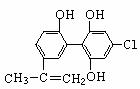
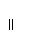
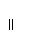
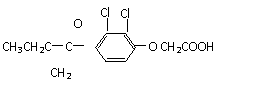
①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是
A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2
C.两种兴奋剂均属于芳香族化合物
 D.两种分子中的所有碳原子均不可能共平面
D.两种分子中的所有碳原子均不可能共平面
12.用NA代表阿伏加德罗常数,下列说法正确的是
A.0℃、2.02×l05帕时,1molCO2的质量为44g
B.7.1g氯气与足量的氢氧化钠溶液反应时,转移电子数为0.2NA个
C.11.2 L HCl气体溶于水,配制成1 L盐酸,其浓度为0.5mol/L
D.足量的铜片与含4 mol HNO3的浓硝酸充分反应生成二氧化氮的分子数为2NA
11.某同学用回收的镁铝合金制取氢气。现有l0.8 g镁铝合金,下列说法正确的是
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol-0.6 mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol-0.6 mol之间
10.常温下,下列有关叙述不正确的是
A.足量铁屑溶于稀硝酸所得溶液中:c(NO3-)>c(Fe2+)>c(H+)>c(OH-)
B.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaHCO3溶液:
c(CH3COONa)>c(NaHCO3) >c(C6H5ONa ) >c(Na2CO3 )
C.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)] > [c(K+)-c(CH3COO-)]
D.10 mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,所得溶液体积V(总)≥20 mL
9.下列离子方程式书写正确的是
A.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O==AgOH↓+NH4+
B.NaHS溶液呈碱性:HS-+ H3O+
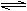
 H2S + H2O
H2S + H2O
C.4 mol/L的KAl(SO4)2溶液与7 mol/L的Ba(OH)2溶液等体积混合:
4Al3++7SO42-+7Ba2++14OH-==2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O
D.食醋清除热水瓶胆水垢:2H++CaCO3=Ca2++H2O+CO2↑
8.用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中转移的电子的物质的量为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
7.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般不需要使用玻璃棒进行操作的是
①用pH试纸测定Na 2CO3溶液的pH
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
④用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
⑤将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
A.②③⑦ B.③④⑤ C.⑤⑥⑦ D.④⑥⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com