
题目列表(包括答案和解析)
6.有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.氧化剂与还原剂的物质的量之比为1︰8
B.该过程说明Fe( NO3)2溶液不宜加酸酸化
C.若有l mol NO3-发生氧化反应,则转移8mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
5.一定能在下列溶液中大量共存的离子组是
A.pH=0的溶液:Al3+、Mg2+、NO3-、I-
B.由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl-
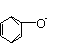 C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.含大量HCO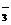 的澄清透明溶液中:Ca2+ 、Na+、
、Cl-
的澄清透明溶液中:Ca2+ 、Na+、
、Cl-
4.短周期元素A、B、C,原子序数依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.A、B、C形成的一种化合物,其水溶液可能呈酸性
B.沸点:A的氢化物低于C的氢化物
C.离子半径:A<B<C
D.5.6 g铁与足量的C化合,转移0.3mol电子
3.下列有关化学用语正确的是
A.乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体
B.北京奥运会奖牌--“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO·5MgO·8SiO2·H2O
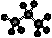 C.次氯酸的结构式为:H-Cl-O
C.次氯酸的结构式为:H-Cl-O
D.丙烷分子的比例模型示意图:
2.下列说法中,正确的是 A.水的离子积KW随温度、外加酸(碱)浓度的改变而改变 B.能自发进行的化学反应,一定是△H<0、△S>0 C.对已达化学平衡的反应,仅改变浓度,若平衡移动,则平衡常数(K)一定改变 D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
1.江苏要建成资源节约和生态保护型省份。下列措施或说法不符合这一理念的是
A.开发风能、生物质能发电,火力发电用煤先进行脱硫处理
B.推广节能、节电技术和化工生产的绿色化学工艺
C.做好空气质量预报工作,以便污染程度高时好防护
D.工业废水经处理后的“再生水”,用于道路保洁、城市喷泉和洗车等
25.(10分)氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312 g,放入烧杯中,加入适量6 mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35 mL 0.25 mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05 mol/L KMnO4溶液16 mL,恰好完全反应。
回答下列问题:
(1)配平: MnO4-+ H2C2O4+ H+― Mn2++ CO2↑+ H2O
(2)0.05mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为 。
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)。
试题到此结束,请认真检查。
24.(10分)
(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示:
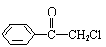 则苯氯乙酮不可能具有的化学性质是 (填字母序号)。
则苯氯乙酮不可能具有的化学性质是 (填字母序号)。
a.加成反应 b.取代反应 c.消去反应
d.水解反应 e.银镜反应
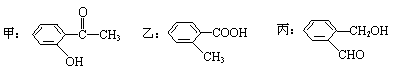
(2)今有化合物
①请写出丙中含氧官能团的名称: ;
②请判别上述哪些化合物互为同分异构体: ;
③请按酸性由强至弱排列甲、乙、丙的顺序: ;
(3)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
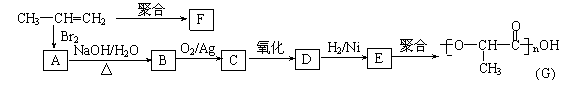
①丙烯分子中,最多有 个原子在同一个平面上;
②聚合物F的结构简式: ;
③B转化为C的化学方程式: ;
④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式: 。
23. (8分)一定条件下,在体积为3 L的密闭容器中, 一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(8分)一定条件下,在体积为3 L的密闭容器中, 一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)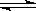 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= , 升高温度,K值 (填“增大”、“减小”或“不变”);
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= ;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 (填字母序号)。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
22.(13分)下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
M |
D |
E |
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
G |
|
|
H |
I |
|
|
|
|
|
|
|
N |
|
J |
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
|
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是________________(填“元素符号”);
(2)下列叙述正确的是_____________(填字母序号);
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
(3)根据VSEPR理论预测DA4+离子的空间构型 ,ME2的空间构型 ;
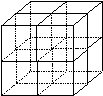
(4)元素F和元素I形成的化合物是 晶体(填晶体类型), 右图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素F和元素I所在位置。
(5)已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
则绿色晶体的化学式为 ,该配合物中的配位体为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com