
题目列表(包括答案和解析)
17. 某实验小组测定某常用食醋的酸量(g/L),拟采用以下方法:
⑴甲同学粗测食醋的酸度:用pH试纸测溶液pH的方法是
。
⑵乙同学较精确的测定食醋的pH:所用仪器是 。
⑶丙同学由乙同学所测结果(pH=2.00)计算得该常用食醋的酸量为0.6 g/L,明显低于正常含量(30~50g/L)其原因是:
⑷丁同学认为以上方法均不能准确测定食醋的酸量并提出中和测定法。甲同学用pH试纸 (填能、否)粗略测得食醋的酸度;要在滴定时准确判断滴定终点,还必须对食醋作何处理?
(5)该实验小组欲测定某市售食用白醋的总酸量(单位:g/100mL),设计实验如下:
Ⅰ.试剂和用品
白醋样品100mL、0.1000 mol·L-1 NaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液
100 mL容量瓶、玻璃棒、胶头滴管、50 mL酸式滴定管、50 mL碱式滴定管、滴定管夹、铁架台、100 mL烧杯、酒精灯、火柴、三脚架、石棉网、pH计
Ⅱ.实验步骤
①用50 mL酸式滴定管移取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却)稀释至刻度线,摇匀即得待测食醋溶液。
②用酸式滴定管量取待测白醋溶液20.00 mL。
③盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。
④滴定,并记录NaOH的终读数。重复滴定2-3次,数据记录如下。
|
滴定次数 实验数据 |
1 |
2 |
3 |
4 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)/mL(初读数) |
0.10 |
0.30 |
0.00 |
0.20 |
|
V(NaOH)/mL(终读数) |
20.08 |
20.30 |
20.80 |
20.22 |
|
V(NaOH)/mL(消耗) |
19.98 |
20.00 |
20.80 |
20.02 |
Ⅲ.数据处理与问题讨论
①本实验需要的试剂是 ,还缺少的一种仪器是________________。
②滴定过程中使用pH计将溶液的pH变化情况记录如下表。
|
V(NaOH)/mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
22.00 |
|
溶液pH |
2.88 |
4.70 |
5.70 |
6.74 |
7.74 |
8.72 |
9.70 |
10.70 |
11.70 |
在允许的误差范围(±0.1%)内,pH突变的范围为______,所以可选择_______作指示剂。
③甲同学在处理数据过程中计算得到平均消耗的NaOH溶液的体积为:
V(NaOH)=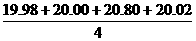 =20.20 mL
=20.20 mL
他的计算合理吗?理由是________________________________________________。
④该市售白醋样品中醋酸的物质的量浓度是_____________mol·L-1,样品总酸量为___________g/100mL。
16.一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H<0。现将1mol
A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
2C(g)+D(g);△H<0。现将1mol
A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增人
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)

第Ⅱ卷(非选择题 共72分)
15.某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
14.下列溶液中各微粒的浓度关系不正确的是( )
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-)>c(NH4+))>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:
c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
13.在水电离出来的[H+]=10-2.5mol/L的溶液中,下列各组离子可大量共存的是( )
A. Ag+ K+ Ba2+ I- B. AlO2- S2- PO43- Na+
C. NH4+ Fe3+ Br- SO42- D. Fe2+ Cu2+ Mg2+ NO3-
12.在FeCl3和AlCl3混合溶液中,先加过量NaI溶液,再加入足量的Na2S溶液,得到的沉淀是( )
A.A12S3、I2 B.Fe2S3、I2 C.S、FeS、Al(OH)3 D.Fe(OH)2、Al(OH)3
11.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是 ( )
A. 在熔融电解质中,O2-由负极移向正极
B.电池的总反应是:2C4H10+13O2 ® 8CO2+10H2O
C. 通入空气的一极是正极,电极反应为:O2+4e-=2O2-
D. 通入丁烷的一极是正极,电极反应为:2C4H10+26e-+13O2-=4CO2+5H2O
10.化学中用类比的方法可预测许多物质的性质。但类同是相对的,推测结果不一定是正确的,下面5个推测中,正确的有( )
①由NH4Cl NH3↑+HCl↑推测:NH4I
NH3↑+HCl↑推测:NH4I NH3↑+HI↑;②由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO推测:SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO;③由2CO2(过量)+Ca(ClO)2+2H2O=Ca(HCO3)2↓+2HClO推测:CO2(过量)+NaClO+H2O=NaHCO3+HClO;④由Na2SO3+2HCl=2NaCl+H2O+SO2↑推测:Na2SO3+2HNO3=2NaNO3+H2O+SO2↑;⑤由2Na2O2+2CO2=2Na2CO3+O2推测:2Na2O2+2SO2=2Na2SO3+O2。
NH3↑+HI↑;②由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO推测:SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO;③由2CO2(过量)+Ca(ClO)2+2H2O=Ca(HCO3)2↓+2HClO推测:CO2(过量)+NaClO+H2O=NaHCO3+HClO;④由Na2SO3+2HCl=2NaCl+H2O+SO2↑推测:Na2SO3+2HNO3=2NaNO3+H2O+SO2↑;⑤由2Na2O2+2CO2=2Na2CO3+O2推测:2Na2O2+2SO2=2Na2SO3+O2。
A.0个 B.1个 C.2个 D.3个
9.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A.1.4g的C2H4和C3H6中含有的原子数为0.3 ×6.02×1023
B.0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5 gSiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
8.、已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量
②①1molCl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量
下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl(g)=2HCl(g)
B.氢气与氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气与氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气与氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com