
题目列表(包括答案和解析)
20.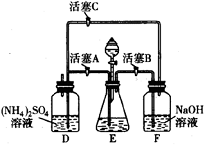 莫尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用右图所示的实验装置来制取莫尔盐,实验步骤如下:
莫尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂。某研究性学习小组用右图所示的实验装置来制取莫尔盐,实验步骤如下:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离,将分离出的NaOH溶液装入F中;
②在E中用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与(NH4)2SO4溶液混合,结晶得到莫尔盐。
试回答下列问题:
(1)利用铁屑和稀硫酸反应产生的氢气赶走装置中的氧气及硫酸铵溶液中溶解的氧,其目的是_________________________________;铁屑和稀硫酸反应产生的氢气的另外一个作用是_______________________________________________。
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
___________________________________________________________________。
(3)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。若取产品24.50g配成100mL溶液,取出10mL用0.10mol·L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL。
①试配平反应的离子方程式:
______MnO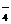 +_____Fe2++_____H+=_____Fe3++______Mn2++
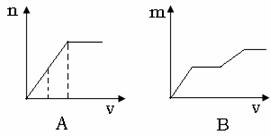
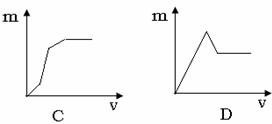
+_____Fe2++_____H+=_____Fe3++______Mn2++
②试求产品中莫尔盐的质量分数_______________ (NH4)2SO4·FeSO4·6H2O的相对分子质量为392)。
19.有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中.的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D ,G ;
(2)D的前一元素第一电离能高于D的原因: ;
(3)由A、B、C形成的ABC分子中,含有 个σ键, 个π键;
(4)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是
(写化学式),原因是 ;
18.某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。请回答下列问题:
⑴在实验①中,下图所示的操作中正确的是_______________(填代号)


⑵根据上述实验判断原溶液中肯定存在的离子是___________________,
肯定不存在的离子是___________________
⑶写出与②③三个实验有关的离子方程式:
②: ___ ___________ ___________ ________ ;
③: ___ ___________ _______ ____________ ;
17.在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应产生①I03-+5I-+6H+=3I2+3H20
②3I2+3HS03-+3H20=6I-+3HS04-+6H+
当反应进行到15min时,溶液突然变为蓝色,随之又很快消失,这一反应称为时钟反应,有人用它来解释生物钟现象。
(1)在KIO3中碘元素的化合价是________,在反应②中还原剂是_______。
(2)在整个反应过程中,起催化作用的物质是_______,
写出总的离子方程式____ ______。
(3)上述两个反应中,反应速率较快的是________(填序号)。
(4)请解释溶液颜色迅速变蓝、又很快消失的原因____ _______.
16.用NA表示阿伏加德罗常数,下列说法正确的是
A.在反应2Sb2S3+3O2+6Fe=Sb4O6+6FeS中每生成3 mol FeS时,共转移3mol电子
B.0.5 mol I-被氧化时失去的电子数为0.5NA
C.过氧化钠与水反应时,每有两个-1价的氧被氧化,必有两个-1价的氧被还原。
D.常温常压下,48 g O3含有氧原子数为3NA

|
15.X、Y、Z是原子序数依次递增的三种短周期元素。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物。则下列说法一定正确的是
A.其中有硫元素 B.其中有金属元素
C.这三种元素能够组成盐 D.这三种元素均位于不同周期
14.下列离子方程式中,正确的是
A.氧化钠投入水中:O2- +H2O== 2OH-
B.在CuSO4溶液中加入过量Ba(OH)2溶液:Ba2+ + SO42- == BaSO4↓
C.氯气通入水中:Cl2 + H2O== Cl- + ClO- + 2H+
D.在AlCl3溶液中加入过量氨水:Al3+ + 3NH3·H2O == Al(OH)3↓ + 3NH4+
13.将Ba(OH)2溶液滴入混有盐酸的MgSO4溶液中,下列曲线不可能的是(纵坐标表示沉淀的量横坐标表示氢氧化钡溶液的体积)
12.在充有空气压强为101kPa的密闭容器中装有HgO和2.3g金属钠,将其加热至500K(HgO受热分解成汞和氧气),使其充分反应,再冷却至室温,若容器内的气体成分未变,那么装入容器中的HgO可能是
A.28.06g B.21.70g C.10.83g D.1.60g
11.下列变化,需加入还原剂才能实现的是( )
A.Br-→Br2 B.NO2-→NO C.ClO3-→Cl- D.Fe→Fe3O4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com