
题目列表(包括答案和解析)
71.按第一电离能递增的顺序排列的是
A、Li Na K B、Na Al S C、P Si Al D、Cl Br I
70.人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子“未成对电子”的说法,错误的是
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子”
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
69.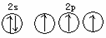 下列表达式错误的是
下列表达式错误的是
A.甲烷的电子式:
B.氮原子的L层电子轨道表示式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12原子:12 6C
68.向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
 D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
67.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
A.反应过程中得到6.72L(标准状况)的气体 B.最终得到7.8g的沉淀
C.最终得到的溶液中c(NaCl)=1.5mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
66.1798年法国化学家对绿柱石和祖母绿进行化学分析发现了铍。已知绿柱石是一种呈绿色的硅酸盐,可表示为BexAly[SimOn](x、y、m、n均为自然数),其中阴离子部分结构如下图所示(已知 表示硅酸根离子SiO44-),下列说法肯定不正确的是

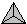 A. 阴离子化学式为:Si6O1612-
A. 阴离子化学式为:Si6O1612-
B. 绿柱石可用氧化物形式表示为:3BeO·Al2O3·6SiO2
C. 绿柱石可表示为Be3Al2[Si3O12]
D. 绿柱石可溶于强碱和氢氟酸
65. 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?) 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,到达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变小
64.有一定质量的KNO3样品,在100C下加蒸馏水使之充分溶解,残留固体的质量为250g。该实验在400C下进行时,残留固体质量为120g,700C时为20g。已知KNO3在不同温度下的溶解度:
|
温度 |
100C |
400C |
550C |
700C |
|
溶解度 |
20g |
65g |
100g |
140g |
下列对该样品的推断正确的是
A、样品为纯净物 B、样品中混有不溶于水的杂质
C、样品中混有溶解度较大的杂质 D、当温度在550C左右时KNO3完全溶解
63.分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上。其晶体中的阴离子晶胞结构如图示,下列说法不正确的是
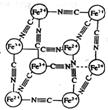 A.该晶体是离子晶体
A.该晶体是离子晶体
B.M的离子位于上述晶胞面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为50%(体心中没有M+占总体心的百分比)
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
62.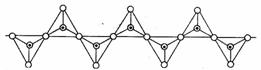 硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以用投影图表示成:
硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以用投影图表示成:
其中○表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的硅酸根离子。试确定在无限长的单链阴离子中(见图),硅原子与氧原子的个数之比为 B
A.1:2 B.1:3 C.2:5 D.2:7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com