
题目列表(包括答案和解析)
1.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
A.从海水中可得到NaCl,电解熔融NaCl或其水溶液都可制得Cl2
B.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质
C.利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向
D.无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能
21.(8分)一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气。实验室通常用该原理制取少量Cl2。
(1)从原子经济学角度出发,要使浓盐酸中Cl-充分转化为Cl2,制取等量的Cl2最好选用上述氧化剂中的 氧化浓盐酸。
(2)将214.5gCa(ClO)2放入500 mL 、12.0 mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2 L。若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度。
(3)漂白粉是 Ca(ClO)2、CaCl2 ·Ca(OH)2 ·H2O 和 CaO 的混合物。漂白粉放出的氯气具有漂白作用,叫有效氯。通常用有效氯表示漂白粉的纯度。漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI ,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定。若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度最好小于 mol/L,测定的有效氯将 (“偏高”、“偏低”或“不变”)。
20.(10分)下图中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下图回答下列问题:
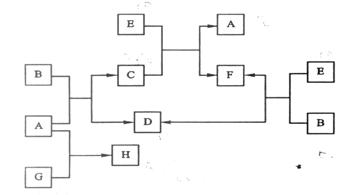
(1)写出C的化学式: 。
(2)E和N2是等电子体,请写出E可能的电子式: 。
(3)若G是一种淡黄色固体单质,16 g G和足量的A反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式: 。
(4) 若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式: ;H的水溶液可与过量的B继续反应,请用离子方程式表示: 。
19.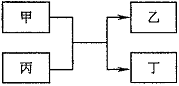 (10分)甲、乙为单质,丙、丁为化合物,它们之间存在如下图所示的转化关系。
(10分)甲、乙为单质,丙、丁为化合物,它们之间存在如下图所示的转化关系。
(1)若甲、乙均为非金属,丙为氧化物,则:
①乙为氧化产物时,乙可能是 (填一种物质的化学式),按照元素周期表推测,此时反应物甲可能
是 (填一种物质的化学式);
②乙为还原产物时,丁所属的物质类别是 。
(2)若该转化关系为我国古代湿法冶炼金属乙的原理,写出此反应的化学方程式 。若该转化关系为高温火法冶炼金属乙的原理,且同时生成的丁是一种有刺激性气味的气体,则丙可能为 (填一种物质的化学式)。
18.(10分)一种澄清透明的溶液中,可能含有下列离子:K+-、Fe3+、Ba2+、Al3+、NH4+、Cl-、NO3-、HCO3-、SO32-、SO42-,现做以下实验:
I.将溶液滴在蓝色石蕊试纸上,试纸呈红色;
II.取少量溶液,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀;
III.将II中的沉淀过滤,向滤液中加入AgNO3溶液,产生白色沉淀;
IV.另取溶液,逐滴加入NaOH溶液至过量,只看到有棕色沉淀生成,且沉淀质量不减少。
由此可以推断:
(1)溶液中肯定存在的离子有____________________;
(2)溶液中肯定不存在的离子有_______________________;
(3)溶液中不能确定是否存在的离子有_______________________。
17.(10分)m、n、x、Y四种主族元素在周期表里的相对位置如右图所示,已知它们的原子序数总和为46,
(1)m与y形成的化合物中含_________键,属__________分子(填“极性”或“非极性”)。
(2)x元素形成的单质属_____________晶体。
(3)由n、y的氢化物相互作用所生成的物质的电子式为__________________。
(4)写出m单质与x元素最高价氧化物对应的水化物的化学反应方程式_____________________________。
(5)核电荷数比x元素少8的元素可形成多种粒子,按要求填入空格中:
|
质子数 |
16 |
16 |
16 |
|
电子数 |
16 |
17 |
18 |
|
化学式 |
|
|
|
16.(10分)铼(Re)是自然界中最后一种被诺达克等三位科学家于1926年发现的元素。他们从数以吨计的含有多种元素的矿石中,通过复杂的工艺一点一滴地富集浓缩,才制得了仅2mg的金属铼。现代工业上采用的方法是:在H2流中于800℃的高温下,使高铼酸钾中的铼元素全部被还原出来。
(1)根据你的理解,请说明铼元素的发现为什么会如此艰难?时间上为什么会如此漫长?__________________________________;_____________________________________。
(2)铼有两种天然同位素:稳定同位素185Re和放射性同位素187Re,两个同位素原子中的中子数之和是______________________。
(3)写出现代工业上用氢气还原金属铼的化学方程式,并标出电子转移的方向和数目________________________________________。
|
m |
n |
|
|
|
|
|
X |
y |
(二)(10分)氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
 (1)某同学提出的假设是
(1)某同学提出的假设是
;
(2)通过实验Ⅰ可以证明
;
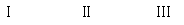 (3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入
,再加入
。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入
,再加入
。
(4)探究结果为 。
(5)你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
 族 族周期 |
ⅦB |
|
4 |
25Mn锰 |
|
5 |
43Te锝 |
|
6 |
75Re铼 |
15.(一)(4分)实验室有下列仪器(用品)和药品。
仪器(用品):①铁架台(附铁圈、铁夹) ②酸(碱)式滴定管 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥天平(含砝码、镊子) ⑦滤纸 ⑧分液漏斗 ⑨双孔橡皮塞 ⑩烧瓶;
药品:碱石灰、Na2CO3固体、NH4Cl固体、MnO2、标准NaOH溶液、未知浓度盐酸、双氧水、蒸馏水。
请按要求填空:
(1)过滤时,缺少的仪器是_______________;
(2)欲配制500mL0.1mol·L-1的碳酸钠溶液,还缺少的仪器是______________________;
(3)若测定未知浓度的盐酸溶液,还缺少的仪器是_________________;
(4)若要测定中和热,还缺少的仪器为温度计、__________________________。
14.25℃时,某硫酸铜溶液的质量分数为w,物质的量浓度为cmol/L,密度为ρg/mL,将此溶液蒸去a g水或再向原溶液中加入b g无水硫酸铜粉末,充分静置并恢复至25℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是
A.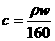 B.
B.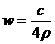 C.
C.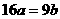 D.
D.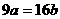
第Ⅱ卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com