
题目列表(包括答案和解析)
7.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( C )
A.NaCl是非电解质
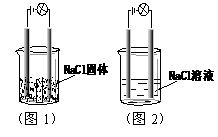 B.NaCl溶液是电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
6.常温下,某溶液中由水电离产生的H+的浓度为1×10-5moL/L,则该溶液中的溶质可能是下列物质中的( C )
A.HCl B.NaHSO4 C.Na2CO3 D.NaCl
5.常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得溶液的pH( B )
A.等于7 B.大于7 C.小于7 D.无法确定
4.已知0.1mol/L的醋酸溶液中存在电离平衡: CH3COOH CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( D )
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( D )
A.加少量CH3COONH4固体 B.降低温度 C.加少量NaCl固体 D.升高温度
3.0.10 mol/L盐酸和0.12 mol/L NaOH溶液等体积混合后,溶液的pH等于( D )
A. 2.0 B. 12.3 C. 1.7 D. 12.0
2.用锌和1mol/L稀硫酸溶液制取氢气,欲提高制取氢气的速率,下列措施不可行的是( A )
A.改用98%的浓硫酸 B.使用更小颗粒的锌粒
C.滴入少量CuSO4溶液 D.加热
1.下列物质,属于强电解质的( C )
A.NH3.H2O B.H2O
C.CH3COONH4 D.CH3COOH
12.地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热,在673K-1123K区间内分解为氧化物,样品总失重13.8mg。
(1)方解石的失重百分比为 ;(2)计算矿物中高岭石的质量分数。
11.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅 ②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl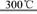 SiHCl3+H2 ③SiHCl3与过量H2在1000-1100℃反应制得纯硅。已知SiHCl3,能与H2O强烈反应,在空气中易自燃。请回答下列问题:
SiHCl3+H2 ③SiHCl3与过量H2在1000-1100℃反应制得纯硅。已知SiHCl3,能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)写出硅的原子结构示意图 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
|
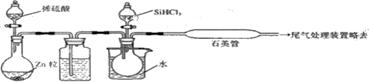
①装置B中的试剂是浓H2SO4,其作用是________________,在上述装置中需要加热的是 (填序号)。
②反应一段时间后,装置D中观察到的现象是 ,已知反应②每生成1molH2时放热381kJ,请写出装置D中反应的热化学方程式______________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
10.硅氧四面体可以用图30-1a表示,图b、c是硅氧四面体结合成环状结构的两个例子。请回答下列问题:
(1)若在环状结构中硅的原于数为n,写出环状结构中硅酸根离子的通式 。
(2)己知绿柱石是由环状硅氧四面体构成的硅酸盐。它是含有铍、铝两种元素的复盐,酸根中含有6个硅原子,铍、铝结合的酸根离子数相等。写出绿柱石的化学式 ,并在此基础上改写成氧化物相结合的形式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com